非洲豬瘟
- 內容
非洲豬瘟實驗室診斷標準操作程序(以下簡稱本標準)所制定之內容係提供於實驗室處理相關病材,進行非洲豬瘟實驗室診斷操作時所必需之程序,以確保檢驗水準之一致。目的 名詞定義 1. 非洲豬瘟: 非洲豬瘟係由非洲豬瘟病毒所引起豬隻之海外惡性傳染病,臨床上由甚急性至不顯性感染均有可能發生,以急性非洲豬瘟最為典型。急性非洲豬瘟以發高熱、網狀內皮系統出血病變和死亡率高為主徵。 2. 臨床診斷: 係依田間罹患豬隻之感染率和死亡率的高低以及發病症狀作疾病初步之判定而言。非洲豬瘟和豬瘟在臨床和病理剖檢病變上極為相似,難以區別。兩者都會產生急性出血性病變,因此有賴實驗室的區別診斷。 3. 實驗診斷: 分為兩種,第一種可將病材乳劑接種於試驗豬隻或健康豬白血球或骨髓細胞培養,作病毒分離;或者將送檢和採集臟器作抹片或冷凍切片的螢光標示抗體染色,檢測組織內之病毒抗原;或者以聚合酶鏈反應檢測病毒去氧核醣核酸基因。第二種為利用間接螢光抗體染色試驗檢測血清或組織液內的抗體。 設施及材料 (1) 實驗室:符合國家安全標準三級負壓隔離實驗室 (2) 高速離心機:Himac SCP 85H2, Hitachi (3) 離心機:Hermle Z360K, BHG (4) 桌上小型離心機:KM-15200, Kubota (5) 顯微鏡:Zeiss, Germany (6) 螢光顯微鏡:Leitz, Germany (7) 冷凍切片機:Bright, UK (8) 乳缽和乳棒:台製 (9) 恆溫箱:Napco, Model 600 (10) 水浴槽:Hotech, water bath 810 (11) 自動控溫循環機:Perkin Elmer Cetus (12) 搖擺器:Flow Laboratories (13) ELISA 光度比色判讀機(ELISA Reader):Dynex (14) 可調式供電器和電泳槽:(Gelman或同級品) (15) 非洲豬瘟病毒株: (16) 肝素:Sigma (17) 乙烯二胺四醋酸鹽(EDTA):Sigma (18) 玻璃粉:台製 (19) 磷酸緩衝液:
加蒸餾水至 1,000mLNaCl (Merck) 8.0 gm KCl (Merck) 0.2 gm Na2HPO4.7H2O (Merck) 2.172 gm KH2PO4 (Merck) 0.2 gm (20) 細胞培養液:
每包 10 公升裝 MEM 鹽基粉末(Gibco) 加入滅菌再製蒸餾水至 10 公升。經溶解後加入 23 gm 的 NaHCO3,以 0.22 μm Milipore 過濾並分裝於 500 mL 血清瓶內,無菌檢定後放入 4 ℃ 冰箱保存備用。(21) 細胞生長液:
每 100 mL MEM 細胞培養液內加入10 mL 胎牛血清(10 %)及抗生素(Penicillin 100 U/mL 和Streptomycin 100 μg/mL),供細胞增殖培養用。(22) 細胞維持液:
每100 mL MEM 細胞培養液內加入 2 mL 胎牛血清(2 %)及抗生素(同細胞生長液),供細胞維持用。(23) 豬白血球培養: (a) 依實際需用量,以肝素抗凝劑(每 mL 血液 100 國際單位)採集健康豬隻血液。 (b) 700 xg,離心 30 分鐘。取出白血球層細胞,並以細胞培養液清洗。 (c) 再離心後之沉澱細胞,以含 10-30 % 豬血清和抗生素之細胞培養液沖散並作成每 mL含 Log 7 個細胞濃度的細胞懸浮液。同時為防止非特異性血球吸附作用,細胞培養液內所加血清需為供應白血球細胞培養之同一頭豬的血清或血漿。 (d) 在每支 160 X 16 mm 試管內,分別注入1.5 mL 白血球細胞懸浮液。然後,傾斜放置 37 ℃ 培養(斜面為 5-10 度)。 (24) 猴源細胞株(Monkey stable cells;MS cells):於 75 平方公分塑膠培養瓶長滿後,將細胞生長液倒出,並於每支塑膠培養瓶加入 5-10 mL 胰蛋白  細胞消化液(Trypsin-Versene)沖洗一次。如此,重複沖洗二次。第二次倒出胰蛋白
細胞消化液(Trypsin-Versene)沖洗一次。如此,重複沖洗二次。第二次倒出胰蛋白 細胞消化液時,留少許消化液於塑膠培養瓶內。將塑膠培養瓶置於 37 ℃ 消化三分鐘或直至細胞脫落後,以原塑膠培養瓶生長液三倍量之細胞生長液沖散細胞並作成細胞懸浮液供用。
細胞消化液時,留少許消化液於塑膠培養瓶內。將塑膠培養瓶置於 37 ℃ 消化三分鐘或直至細胞脫落後,以原塑膠培養瓶生長液三倍量之細胞生長液沖散細胞並作成細胞懸浮液供用。(25) Dextran 150:Hisons, UK 牌 (26) 丙酮:Merck (27) 甘油:Merck (28) Taq DNA 聚合酶和10 X 聚合酶鏈反應緩衝液:(Protech) (29) 1.25 mM dNTP 混合溶液:在 360 μL 無 菌蒸餾水中,各別加入 10 μL 濃度為 50 mM 的 dATP,dCTP,dGTP 和dTTP (Phamacia)。 (30) 引子溶液濃度 50 pmol/μL:引子1,序列為 5'-ATGGA TACCG AGGGA ATAGC-3'(正鏈);引子2,序列為 5'-CTTAC CGATG AAAAT GATAC-3'(負鏈)。 (31) 載入緩衝液(loading buffer):為含 0.25 % Orange G之30 % 甘油溶液。 (32) 50 X TAE 緩衝液:供洋菜膠片配製用。配方,Tris base(242g);Glacial acetic acid (57.1mL);pH 8.0,0.5 M EDTA(100 mL)。加蒸餾水至 1 公升。 (33) 標記 DNA(Marker DNA):市售不同分子量的 DNA 標記溶液,為 100 bp Ladder 標記 DNA。(Gen Sura Lab. Inc.) (34) 蔗糖:Merck (35) Tris-HCL:Sigma (36) Nonidet P-40:Sigma (37) β-mercaptoethanol:Sigma (38) NaCL:Merck (39) 碳酸鈉:Merck (40) 碳酸氫鈉:Merck (41) ELISA 專用 96 孔盤:Nunc Immunoplate (42) Tween 20:Merck (43) 蔊菜過氧化酶標幟蛋白 A:Caltag Lab. (44) Ortho-phenylenediamine(OPD):Sigma (45) 雙氧水:Merck (46) 硫酸液:Merck (47) 抗豬免疫球蛋白螢光標示抗體:Jackson Immunoresearch (48) 標準分子量蛋白液:Bio-Rad (49) Acrylamide:Bio-Rad (50) N,N'-diallytartardiamide:Bio-Rad (51) 硝纖膜(Nitrocellulose membrane):Amersham (52) 甲醇:Merck (53) 甘胺酸(Glycine):Merck (54) 脫脂奶粉:Marvel (55) 氯奈酚(chloranaphthol):Merck (56) Whatman 1 號濾紙:Whatma (57) 疊氮鈉:Merck (58) PH 8.6 Veronal acetate 緩衝液: Sodium barbital(Merck) 13.38 gm Sodium acetate(Merck) 8.83 gm 加入蒸餾水至 1.5 公升以濃鹽酸(HCl)調整 PH 至 8.6 (59) Agarose:(Difco或同級品) (60) 冰醋酸:(Merck或同級品) (61) Amido black:(德國製 Leverkusen ) 非洲豬瘟病原的檢測 1. 病材的採集和輸送: 非洲豬瘟可疑病例,應以肝素或乙烯二胺四醋酸鹽(EDTA)抗凝劑採集血液,並將採集之脾臟、扁桃腺、腎臟和淋巴結等臟器一起於低溫冷藏情況下快速送抵診斷實驗室。輸送途中不宜冷凍。 2. 病材乳劑的製備: (1) 將病材剪切成小塊放置乳缽內,加入滅菌細沙或玻璃粉後以乳棒磨碎,再加入 5-10 mL含抗生素之鹽類緩衝液或細胞培養液。 (2) 經 1,000 xg,離心 5 分鐘。取出上清液供血球吸附試驗和試驗豬接種用。 3. 血球吸附試驗(Haemadsorption test): 血球吸附試驗,係將可疑患畜血液或臟器乳劑上清液接種於健康豬初代白血球細胞培養(方法1);或者將田間可疑患畜血液或試驗接種豬血液直接作成白血球細胞培養(方法2)。 (1) 豬初代白血球細胞培養之血球吸附試驗(Haemadsorption test in primary leukocyte cultures): (a) 將每一病材乳劑之上清液分別接種於 3 支白血球細胞培養試管內,每管接種 0.2 mL。同時為防止田間送檢病材因保存狀況不佳帶來負面影響,最好也將 10 倍和 100 倍稀釋後上清液接種於白血球細胞培養。 (b) 另外接種有血球吸附性之非洲豬瘟病毒,作為陽性對照;並保留未接種白血球細胞培養,當陰性對照,觀察有無非特異性血球吸附現象。 (c) 接種後第 3 天,於每支試管內分別加入0.2 mL以鹽類緩衝液新鮮配製之 1 % 豬紅血球細胞懸浮液。 (d) 在顯微鏡下每日觀察細胞病變作用和血球吸附現象,並以第 7-10 天為最終判讀時間。 (e) 判讀:有血球吸附現象產生時,在感染細胞表面可見諸多紅血球的附著。如果僅見細胞病變作用,試管底部附著細胞數顯著減少而無血球吸附現象時,可能係因接種液之細胞毒性作用、假性狂犬病病毒或無血球吸附性之非洲豬瘟病毒等因素所引起。需將培養細胞離心後作螢光標示抗體染色,或實施聚合  鏈反應(參閱下述)予以區別診斷。若接種細胞正常,無任何變化,或經螢光標示抗體染色和聚合
鏈反應(參閱下述)予以區別診斷。若接種細胞正常,無任何變化,或經螢光標示抗體染色和聚合 鏈反應後均呈陰性,則需將接種細胞上清液再行繼代接種於新白血球細胞培養。
鏈反應後均呈陰性,則需將接種細胞上清液再行繼代接種於新白血球細胞培養。(2) 感染豬白血球自體玫瑰花瓣狀血球吸附試驗(Haemadsorption autorosette test): (a) 以注射針筒抽取 2 mL 生理鹽水配製之2,000 國際單位之肝素溶液後,採集田間可疑罹患豬 20 mL 血液。混合後,放入玻璃試管或窄瓶內。 (b) 將試管或窄瓶垂直放置在 37 ℃ 恆溫箱或水浴槽,使血球細胞自行沉降。或者在抗凝血液內加入 2 mL 血漿容積擴張劑,例如Dextran 150 溶液,以加速血球的沉降。Dextran 150 溶液,係一種溶解於 0.9 % 生理食鹽水的Dextran 150 注射液。 (c) 經 37 ℃ 放置培養 6-8 小時後,每隔2-3 小時抽取出少量富含白血球並混些紅血球層之懸浮液,放置玻片上。於顯微鏡下觀察血球吸附現象。 4. 非洲豬瘟螢光標示抗體染色試驗: (1) 將送檢或試驗接種豬隻臟器作冷凍切片或抹片,或者將接種乳劑之白血球細胞培養離心後作成細胞抹片。風乾後以丙酮於室溫固定10 分鐘。 (2) 滴上適當稀釋之非洲豬瘟螢光標示抗體,於37 ℃ 保濕盒內進行螢光標示抗體染色1 小時。 (3) 同時將陽性、陰性臟器和白血球細胞作冷凍切片和抹片之螢光標示抗體染色,供對照參考用。 (4) 經磷酸緩衝溶液清洗過後滴一滴磷酸緩衝溶液/甘油混合液並蓋上蓋玻片。然後於螢光顯微鏡下鏡檢。 (5) 判讀:細胞質內呈現顆粒狀特異性螢光者判為陽性。 5. 聚合酶鏈反應: (1) 剪取小塊臟器放置乳缽內,加入滅菌細沙並以乳棒磨碎後加入 5-10 mL 含 1% 公牛血清和抗生素之磷酸緩衝溶液作成 10% 乳劑。 (2) 500 xg,離心 5 分鐘。 (3) 吸取 500 μL 上清液,放入有螺旋蓋Eppendorf 試管內並煮沸 10 分鐘。 (4) 在桌上小型離心機,13,000 xg,離心 5 分鐘。取出上清液後即可供聚合酶鏈反應用。 (5) 依需用試管數,於每支 0.75 mL 之 Eppendorf 試管內,分別加入下列試劑:滅菌蒸餾水 24.5μL,10X 聚合酶鏈反應緩衝液5 μL,1.25 mM dNTP 混合液8 μL,引子1溶液 1 μL,引子 2 溶液1 μL,組織上清液 10 μL 和 Taq DNA 聚合  0.5 μL 等。
0.5 μL 等。(6) 不加組織上清液之對照用試管:陰性對照(無DNA),以 10 μL 蒸餾水取代組織上清液;陽性對照,則以 2 μL非洲豬瘟病毒DNA 和8 μL 蒸餾水取代組織上清液。 (7) 於每支試管混合液之上端加入 60 μL礦物油。 (8) 將全部試管放入 DNA 自動控溫循環機,並依序進行下述反應作用:94 ℃ 5 分鐘,50 ℃ 2 分鐘和 72 ℃ 3 分鐘,單一循環;94 ℃ 1 分鐘, 50 ℃ 2 分鐘和 72 ℃ 3分鐘,三十次循環;最後為 94 ℃ 1分鐘,50 ℃ 2 分鐘和 72 ℃ 10 分鐘,單一循環。然後保持在 4 ℃。 (9) 反應結束後,從每支試管礦物油下層小心抽取 20 μL 反應液,放置在另一新試管內並加入 2 μL 載入緩衝液。 (10) 混合後,逐一載入以每 mL 含 0.5 μg 溴化乙基啶 TAE 緩衝液配製之 2% 洋菜膠片孔洞內。每一膠片留一孔,載入標記 DNA 溶液。 (11) 150 伏特定電壓,電泳 2 小時。 (12) 判讀:將電泳後洋菜膠片放在紫外燈光源上方觀察結果。陽性病材之聚合酶鏈反應產物與陽性對照一樣會在同一位置呈現一特異線條(Band)。比照標準標記 DNA 推算出陽性PCR 產物大小,長度為 278 個 bp(Base pairs)。而陰性對照和陰性病材則無此產物。 6. 豬隻接種試驗: (1) 將病材乳劑上清液混合後接種於四隻試驗豬隻,其中兩隻為豬瘟疫苗免疫豬,而另外兩隻則未免疫豬,每一豬隻肌肉接種 2 mL 混合液或全血。 (2) 接種後每日觀察接種試驗豬隻之臨床症狀,並量肛溫,至接種後第 21 天為止。觀察期間,每日採血作自體玫瑰花瓣狀血球吸附試驗,並將採集血液接種於健康豬初代白血球細胞培養以觀察血球吸附現象。 (3) 判定:若是非洲豬瘟,兩組試驗豬隻接種後幾乎同時發病,有熱反應(≧40 ℃)或有明顯症狀豬隻其體內各臟器均有高力價病毒的存在。試驗接種豬發病時,或在接種後第21 天試驗結束時,至少犧牲一隻試驗接種豬並採集臟器作冷凍切片螢光標示抗體染色以檢測病毒抗原,同時將臟器乳劑接種於豬白血球細胞培養以分離病毒,並採血檢測血清內抗體。若豬瘟免疫組豬隻正常而未免疫組豬隻發病時,則需作豬瘟的診斷。 (4) 結果若為疑陽性,應再重覆繼代接種。 非洲豬瘟血清學的檢測 1. 酵素結合免疫吸附試驗(Enzyme-linked immuno-sorbent assay;ELISA): 酵素結合免疫吸附試驗,可以直接檢測非洲豬瘟感染豬體內的抗體,目前已成國際貿易上一項標準抗體檢測方法。 (1) 抗原的製備 (a) 猴源細胞株(Cells)經接種馴化病毒(10 MOI)後,以含 2% 豬血清的細胞培養液培養增殖。 (b) 細胞經感染 36-48 小時有大量細胞病變作用產生時,將感染細胞收集起來。以磷酸緩衝溶液沖洗過後,650 xg,離心 5 分鐘。沉澱細胞再以含 0.34 M 蔗糖之 pH 8.0,5 mM Tris-HCl 溶液清洗一次。離心,沉澱感染細胞。以下 c. 至 e.項步驟請在冰浴中操作。 (c) 沉澱之感染細胞,以含 67 mM 蔗糖之 pH 8.0,5 mM Tris-HCl 溶液沖散後靜置 10 分鐘。 (d) 加入 Nonidet P-40 非離子清潔劑最終濃度為 1%(W/V)。靜置 10 分鐘,以溶解細胞。 (e) 加入蔗糖至最終濃度為 10%(W/V)後,1,000xg ,離心 10 分鐘,以沉澱核酸。 (f) 取出上清液,分別加入 EDTA,β-mercap-toethanol 和 NaCL (最終濃度分別為 2 mM ,50 mM 和 0.5 M)後於 25 ℃ 作用15 分鐘。 (g) 將含 20% 蔗糖(W/W)之 PH 8.0,50 mM Tris-HCl 溶液先行加入離心管內,然後沿管壁慢慢加入上述混合溶液。4 ℃,100,000 xg 離心一小時。離心後即刻取出蔗糖溶液上一層抗原液,放置 -20 ℃ 冰櫃,即可供酵素結合免疫吸附試驗抗原用。 (2) 試驗步驟 (a) 抗原先以 pH 9.6,0.05 M 碳酸鈉-碳酸氫鈉緩衝液適當稀釋後,於 ELISA 專用 96孔微量盤每孔加入 100 μL ,將抗原覆蓋(Coat) 於孔底。 (b) 4 ℃,感作 16 小時(過夜)後,以 pH 7.2,磷酸緩衝溶液清洗五次。 (c) 將欲測血清以及陽性和陰性對照血清以含0.05 % Tween 20 之磷酸緩衝溶液稀釋 30倍。然後於 ELISA 抗原盤每孔加入 100 μL的稀釋血清,每一稀釋血清兩孔。若將陽性和陰性對照血清分別加入 ELISA 抗原盤四處不同部位,每處各兩孔,則每盤可檢測40 個血清樣品,每樣品兩孔。 (d) 將盤子放置 37 ℃ 搖擺器上感作一小時。然後,以磷酸緩衝溶液清洗五次。 (e) 蔊菜過氧化  標幟蛋白 A 經含 0.05% Tween 20 之磷酸緩衝溶液適當稀釋後於每孔分別加入100 μL。
標幟蛋白 A 經含 0.05% Tween 20 之磷酸緩衝溶液適當稀釋後於每孔分別加入100 μL。(f) 將盤子放置 37 ℃ 搖擺器上感作一小時。然後,以磷酸緩衝溶液清洗五次。 (g) 在 25 mL 受質溶液(含 0.04% OPD 之磷酸-枸椽酸鹽緩衝液)內加入 10 μL 雙氧水後,每孔加入 100 μL 受質溶液。 (h) 放置室溫約作用 10 分鐘。所需呈色時間依當時加入之受質溶液溫度和室溫高低而定。 (i) 每孔加入 100 μL 之 1 M 硫酸液,以停止反應作用。 (j) 判讀:陽性血清,呈黃顏色反應,可用肉眼直接判定。但為求判定標準的一致性,需藉ELISA 光度比色判讀機以波長 492 nm 測定每孔吸光值。同一盤內,任何血清的吸光值只要超過陰性對照血清平均吸光值的兩倍以上即判為陽性。 2. 間接螢光抗體試驗(Indirect fluorescent ant-ibody test): 非疫區 ELISA 判定為陽性之個體血清以及疫區 ELISA 無法判定之血清,需以間接螢光抗體試驗再予確認。 試驗步驟: (1) 將感染非洲豬瘟病毒之豬腎或猴源細胞株作成每 mL 含 5 X Log 5 個細胞懸浮液。然後在每一玻片上滴一小滴,塗抹開後風乾。再以丙酮於室溫中固定 10 分鐘。感染細胞抹片可存放在-20 ℃ 冰櫃,以便隨時取用。 (2) 欲測血清經 56 ℃ 處理 30 分鐘。 (3) 欲測血清、陽性和陰性對照血清先以食鹽緩衝液適當稀釋後分別滴於非洲豬瘟病毒感染細胞抹片和未感染對照細胞抹片。放置37 ℃ 潮濕箱盒內感作一小時。 (4) 抹片經磷酸緩衝溶液清洗過後再以蒸餾水清洗一次。 (5) 在每一抹片上滴上適當稀釋之抗豬免疫球蛋白螢光標示抗體,或異硫氰酸螢光素標幟蛋白 A 液體。放置 37 ℃ 潮濕箱盒內感作一小時。 (6) 抹片經磷酸緩衝溶液清洗過後再以蒸餾水清洗一次。然後滴上一滴磷酸緩衝溶液/甘油混合液,蓋上蓋玻片後於螢光顯微鏡下鏡檢。 (7) 判讀:先觀察陽性和陰性對照血清,陽性對照血清只能於感染細胞抹片呈現特異性螢光,而其他均需為陰性。若欲測血清於感染細胞呈現特異性螢光時則判為陽性。 3. 免疫墨漬試驗(Immunoblotting test): 免疫墨漬試驗可用以取代間接螢光抗體試驗確認疑陽性個體血清。 (1) 抗原條帶膜的製備 (a) 免疫墨漬試驗用之感染細胞質內可溶性病毒蛋白的製備與 ELISA 抗原的製備同。 (b) 利用已知分子量蛋白液作標準對照,將製備抗原與標準分子量蛋白液分別於 17 % Acrylamide /N,N'-diallytartardiamide (DATD) 膠體片上電泳。 (c) 電泳後,將膠體片與 14 X 14 平方公分大小的硝纖膜(Nitrocellulose membrane) 一起放入含 20 % 甲醇之 pH 8.3,196 mM甘胺酸,25 mM Tris-HCl 轉移溶液內(Transfer buffer)。以 5 mA/cm 定電流電泳,將膠體片上的蛋白轉移至硝纖膜上。 (d) 硝纖膜經乾燥後於蛋白面上作記。 (e) 從邊緣切取出一條帶狀膜並進行下述免疫墨漬試驗步驟。與標準分子量蛋白比對,標出23-35 KDa 分子量蛋白部位。然後橫切成寬0.5 cm 條帶狀並於蛋白面上作記,即成抗原條帶膜。這些抗原條帶膜(長約 4 公分) 上的抗原當進行免疫墨漬試驗時會與急性感染豬或耐過豬血清內的抗體相互作用。 (2) 試驗步驟 操作過程中,抗原條帶膜之病毒蛋白標示面需保持朝上。 (a) 將抗原條帶膜浸入阻滯緩衝液(Blockingbuffer;含 2 % 脫脂奶粉之 PBS 溶液)內。於 37 ℃ 不停搖動,作用 30 分鐘。 (b) 將欲測血清以及陽性和陰性對照血清以阻滯緩衝液作 40 倍稀釋。 (c) 將抗原條帶膜浸入欲測血清稀釋液內,於37 ℃ 不停搖動,作用 45 分鐘。同樣將兩條抗原條帶膜分別浸入陽性和陰性血清稀釋液內,以供對照用。作用時間結束後將抗原條帶膜以阻滯緩衝液清洗四次,最後一次則將抗原條帶膜浸泡於阻滯緩衝液內並不停地搖動 5 分鐘。 (d) 山洋葵過氧酵素標幟蛋白 A,經阻滯緩衝液適當稀釋後加入每一抗原條帶膜並於 37 ℃ 不停搖動,作用 45 分鐘。然後,以阻滯緩衝液清洗四次,最後一次則將抗原條帶膜浸泡於阻滯緩衝液內並不停地搖動 5 分鐘。 (e) 配製受質溶液,加入每一抗原條帶膜後於室溫中不停地搖動作用 5-15 分鐘。氯奈酚受質溶液的配製:受質溶液使用時才配製。將 2 mg 之 4-氯1-奈酚(4-chloro-1- Naphthol)溶解於 2 mL 甲醇內。然後,慢慢加入攪拌中之 10 mL PBS 溶液。再以Whatman 1 號濾紙過濾,除去白色沉澱物。然後在過濾液內加入 4 μL 之 30 % 雙氧水。 (f) 當病毒蛋白條紋呈現清楚黑色時以蒸餾水停止其反應作用。 (g) 判讀:陽性欲測血清會與抗原條帶膜上一種以上的病毒蛋白作用,其作用模式及呈色強度和陽性對照血清同。 4. 相對免疫電泳試驗(Counter immunoelectropho-resis test;Immunoelectro-osmophoresis test): 免疫電泳試驗極為快速,只要 30 分鐘即可獲得結果。唯敏感度較低,只適用於整群豬血清抗體的篩檢用。 試驗步驟: (1) 依實際需用量,將 2.5 X 10 cm 玻片放置平臺玻片架上。 以含 0.1% 疊氮鈉之 pH8.6 Veronal acetate 緩衝液(離子強度為0.025) 配製 0.6% Agarose,經加熱溶解後倒入每一玻片上。靜置、凝固。 (2) 在每一玻片膠體上,以鑿洞器挖取直徑 3 mm 洞距 10 mm 的四組孔洞,如下圖所示。 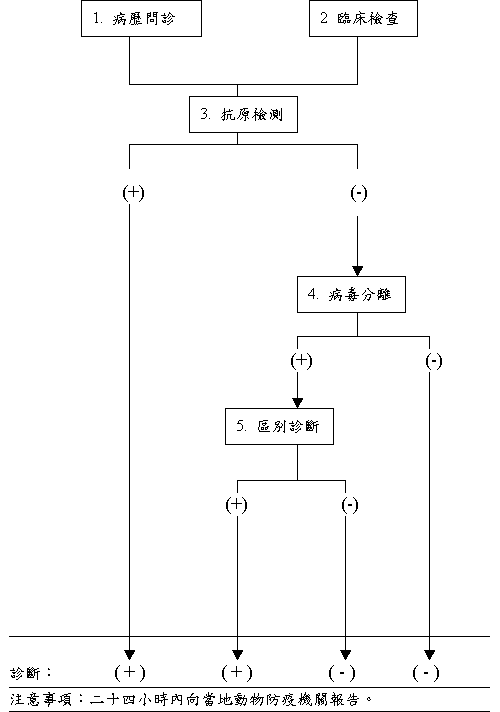
(3) 利用毛細管抽取欲測血清以及陽性、陰性對照血清和陽性、陰性對照抗原等試劑分別注入膠體組洞內。 (4) 將玻片架放入電泳槽內,以 19 伏特/公分定電壓電泳 30 分鐘。 (5) 電泳後,將玻片放置間接光源上方觀察抗原、抗體組洞間有無特異沉降線產生。 (6) 將玻片浸泡於 2% 氯化鈉溶液內一夜。然後以蒸餾水浸泡並每隔兩小時更換蒸餾水一次。經更換數次後予以乾燥。 (7) 乾燥玻片以染色液染色 5-10 分鐘。染色液的配製係將 12 % 醋酸, 1.6 % 醋酸鈉溶液與等量甲醇混合後,再加入 0.007 % 甘油和 0.075 % Amido black 配製而成。染色後,將玻片浸泡於含 45 % 甲醇和 10 % 冰醋酸之脫色溶液內進行脫色,並每隔 10 分鐘更換脫色溶液,如此重複更換三次。 (8) 判讀:經染色和脫色後,在抗血清和抗原組洞間只要有沉降線出現者即判定為陽性。 隔離負壓實驗室操作之安全考量 1. 進入隔離實驗室時需先行於外更衣室脫光全衣物並將衣物放置鎖櫃內或掛鉤上。取下裝飾品例如戒指、首飾、手鐲、手錶以及眼鏡,放在外更衣室內。隔離負壓實驗室內最好另行放置一付眼鏡,否則離開隔離實驗室前需將眼鏡浸泡於消毒液內再以清水洗淨後戴出。然後赤裸地經由通道進入內更衣室。在內更衣室穿戴實驗衣褲、鞋帽後即可進入實驗室內。 2. 離開隔離負壓實驗室時需先行進入內更衣室脫去全身實驗衣褲、鞋帽。還要穿的實驗衣褲、鞋帽整齊放置在內更衣室衣櫥或掛鉤上,髒實驗衣褲、鞋帽則放進洗衣桶內以便消毒清洗。 眼鏡若要戴出應浸泡於消毒液內,但最好能另配一付眼鏡專供隔離負壓實驗室內使用。然後再進入淋浴棚內淋浴消毒,此時即可從消毒液內取出要戴出的眼鏡,以便淋浴時沖洗。在淋浴棚內使用消毒藥皂和洗髮精,塗滿全身肌膚和頭髮。頭上和身上肥皂水,應沖洗乾淨後再進入外更衣室。以架子上浴巾擦乾身體和頭髮。用過浴巾,放入外更衣室洗衣桶內。然後穿上自己衣著後由外更衣室門戶離開隔離負壓實驗室。 3. 採用安全吸管裝置,禁止以口吸吸管。 4. 病材乳劑之製作、細胞接種及抗體檢測需在負壓之生物級安全操作箱內進行。剩餘病材及使用過器材需放入不銹鋼盆或桶內,蓋上蓋子再移出負壓生物級安全操作箱並作高壓蒸汽消毒。 5. 操作完畢後以適當消毒劑噴灑操作箱之操作台,並開啟紫外線燈。 6. 操作過程中所使用之試管、離心管均需為螺旋蓋型。 實驗室器械及廢棄物之處理 1. 剩餘病材:可暫時密封冷凍保存於-70℃專用冰櫃待實驗流程圓滿完成後,取出經 120℃,20 分鐘之高壓蒸汽消毒後焚燬。 2. 可重覆使用之器械如刀剪、鑷子等收集於密閉容器內經高壓蒸汽處理後清洗。 3. 丟棄式之隔離實驗室衣帽和手套,收集於密閉袋內經高壓蒸汽處理後方可丟棄或焚燬。 ◎ 檢測流程圖 ◎

