牛流行熱
- 作者
- 丁履紉
- 建立日期
- 96年01月11日
- 更新日期
- 96年01月11日
- 內容
牛流行熱實驗室診斷標準作業程序(以下簡稱本標準)所制訂之內容係提供於實驗室處理相關病材,進行牛流行熱病毒分離及鑑定操作時所必須遵循之程序,以確保實驗室及操作人員之安全。目的 名詞定義 1. 牛流行熱: 牛流行熱是由桿狀病毒科 (Rhabdoviridae) 的流行熱病毒感染所引起,由吸血性節肢動物傳播的急性傳染病。發病時呈一短暫高熱 (41~42℃)、精神沉鬱、呼吸急促、四肢僵硬及跛足等症狀,病毒可感染的動物有乳牛、黃牛、水牛,甚至鹿也有類似病例。 2. 牛流行熱病毒: 牛流行熱病毒是單股 RNA病毒的桿狀病毒,病毒顆粒呈子彈形或是桿狀而名之,病毒顆粒直徑為 70~80 nm,長 90~180 nm,有的呈185x75nm之圓錐型或子彈型的病毒。 設施及材料 (1) 實驗室:符合國家安全標準II級實驗室 (2) 高速離心機:Himac SCP 85H2, Hitachi (3) 離心機:KOKUSAN, H-103N (4) 桌上小型離心機:KM-15200, Kubota (5) 顯微鏡:Zeiss, Germany (6) 恆溫箱:Napco (7) 旋轉振盪器 (rocker):HIS-50 (8) 水浴槽 (water bath) :Hotech-810 (9) 酸鹼值測定器 (pH Meter):JENCO6091 (10) 自動控溫循環機:Perkin Elmer Cetus 9600 (11) 可調式供電器和電泳槽:Mupid-2同級品 (12) 螢光顯微鏡:ZEISS, Axiophot (13) 已滅菌之乳缽和乳棒(台製) (14) 25 cm2無菌塑膠培養瓶:Nunc® (15) 96孔微量培養盤:Nunc® (16) 15 mL離心管 (17) 1.5 mL微量離心管 (18) 0.2mL PCR用微量離心管 (19) 分注器 (pipette aid) 及1-10mL各式滴管 (pipette) (20) 微量分注器 (pipetteman) 及各式滴尖 (tip) (21) 30G ,0.03 mL胰島素注射用針組 (BD) (22) 一日齡哺乳健康小白鼠 (23) 小白鼠籠子、飲水器、墊料、飼料 (24) 牛流行熱病毒株 (25) 牛流行熱標準血清 (26) BHK-21 (baby hamster kidney) 株化細胞 (27) Vero株化細胞 (28) Hmlu株化細胞 (29) 兔抗牛IgG免疫球蛋白螢光標示抗體:Jackson (30) 肝素 (heparin):Sigma (31) 核醣核酸萃取劑:TRIzol® (32) 氯仿 (chloroform) : Merck (33) 絕對乙醇 (absolute ethanol) : Merck (34) 異丙醇 (isopropanol) : Merck (35) 丙酮 (acetone) : Merck置於-20℃ (36) 磷酸緩衝食鹽溶液:
以121 ℃ 15 lb / cm2高壓滅菌20分鐘。並以T.S.A. Agar 作無菌檢定通過後放入 4 ℃ 冰箱保存備用。NaCl (Merck) 8.0 gm KCl (Merck) 0.2 gm Na2HPO4.7H2O (Merck) 2.172 gm KH2PO4 (Merck) 0.2 gm 加蒸餾水至 1,000 mL (37) 細胞培養液:
每包 1 L裝 MEM 鹽基粉末 (Gibco) 加入滅菌的二次蒸餾水至 1 L。經溶解後加入 2.3 gm 的NaHCO3,以0.22μm Millipore 過濾並分裝於 500 mL 血清瓶內, TSA agar無菌檢定通過後放入 4 ℃ 冰箱保存備用。(38) 細胞生長液:
每 100 mL MEM 細胞培養液內加入10 mL 胎牛血清(10%) 及抗生素 (penicillin 100 U/mL 和streptomycin 100 ug/mL,供細胞增殖培養用。(39) 細胞維持液:係於每 100 mL MEM 細胞培養液內加入 2 mL 胎牛血清 (2%)及抗生素(同細胞生長液),供細胞維持用。 (40) 引子溶液:
引子1 (BEF gp1F442) (濃度為5μM)
引子2 (BEF-gp1R1045)(濃度為5μM)
引子3 (BEF gp1F545) (濃度為5μM)
引子4 (BEF-gp1R785) (濃度為5μM)(41) 1.25 mM dNTP 混合溶液:
在 360μL 無菌蒸餾水中,各別加入 10μL 濃度為 50mM 的 dATP,dCTP,dGTP 和dTTP (phamacia)。(42) 100 bp DNA分子量標記(Gen Sura Lab. Inc.) (43) 載入緩衝液 (loading buffer) 為含 0.25% Orange G 之 30% 甘油溶液。 (44) 50 X TAE 緩衝液:
加蒸餾水至 1 L。供洋菜膠片製作和電泳用。Tris base 242 g Glacial acetic acid 57.1 mL (pH 8.0) 0.5 M EDTA 100 mL (45) 2﹪瓊脂膠溶液 (agarose): 取2 g agarose (Difco或同級品)加入100 mL之1x TAE電泳緩衝液配製成2﹪瓊脂膠溶液,以微波爐加熱溶解瓊脂膠直到呈現完全透明狀態。置於55℃恆溫水槽中,待內外溫度平衡後加入50 ng之溴化乙醯液(ethidium bromide)將膠液倒入製膠台中,插入電泳梳(comb),待膠液冷卻凝固後拔出電泳梳。將膠片裝入塑膠袋密封後,置入4℃冰箱中保存。 (46) Buffered glycerol mounting medium: 磷酸緩衝溶液/甘油混合液 (1:1) 並混合均勻。 (47) AMV反轉錄聚合酶 (promega; 10U/mL) (48) prozymeTM聚合酶 (protech; 2U/mL) (49) 10 X prozymeTM 聚合酶緩衝液 ( protech) (50) rRNasinR (protech; 40U/mL) 初代分離培養樣品採集與處理 1. 可疑牛隻病例應先以肝素(每mL血液100 國際單位)抗凝劑採集血液至少約10mL,剖檢後採集其肺、氣管、脾等臟器一起於低溫冷藏情況下快速送抵診斷實驗室,輸送途中不宜冷凍。 2. 抗凝血液約10mL(添加肝素採集脫纖血),送到實驗室後,血液先經750xg離心5分鐘,分離出血球層及血漿層,經分別收集血漿層後,血球層部份加入無菌的磷酸緩衝食鹽溶液 (PBS) 至原來的採集量 (約10mL)。以搖晃混合後再經750xg離心5分鐘,將上層的 PBS溶液去除。再以 PBS 溶液如上述方法清洗血球液3次後,再以PBS還原為原來全血容積,經混合均勻後分裝再置入 -70 ℃冷凍保存供病毒分離之用。 3. 病材乳劑的製備: 臟器病材約0.5g以無菌剪刀和鑷子剪切成小塊,放置無菌乳缽內以乳棒磨碎,再加入 5 mL細胞培養液沖散後移至15mL離心管內,經 1,000 xg 低溫離心 5 分鐘,收集上清液即製成10%(W/V)乳劑,供病毒分離用。 牛流行熱病毒之鑑定 1. 株化細胞分離病毒與同定: 病毒分離之診斷是以上述的血球液或臟器乳劑接種繼代細胞,如BHK-21、Vero及Hmlu等株化細胞。 (1) 細胞繼代: (a) 以目視及鏡檢選取生長良好,無污染細胞株於25 cm2塑膠培養瓶長滿後,於無菌操作台內操作。首先抽棄培養液,並於每支塑膠培養瓶加入 3-5 mL 胰蛋白酶細胞消化液(trypsin)沖洗一次。如此,重複沖洗二次。第二次倒出胰蛋白細胞消化液時,留少許消化液於塑膠培養瓶內。 (b) 將塑膠培養瓶置於 37℃ 消化三分鐘或直至細胞脫落後,注入15mL細胞生長液用滴管將細胞沖散作成細胞懸浮液並計算細胞數。 (c) 取0.1mL上述細胞懸浮液加入0.9mL 0.4% trypan blue染劑。以細胞計數器,計算細胞數。加入適量細胞培養液,將其濃度調整為5x105 細胞/亳升。 (d) 各取5mL細胞懸浮液分別注入三支25 cm2角瓶內,置入34℃恆溫箱中培養。 (2) 病材乳劑接種: (a) 待細胞增殖成單層細胞後(約第二天後),取三支25 cm2角瓶將瓶內培養液吸除,加入等量的細胞培養液輕輕洗去細胞碎片後吸除培養液,再重複沖洗一次。 (b) 一支瓶內接種0.5mL的血球或10%臟器乳劑;一支接種0.5mL的細胞培養液做為陰性對照;另一支接種0.5mL牛流行熱病毒做為陽性對照,三支同時置於旋轉振盪器之上於34℃恆溫箱中,進行一小時感作反應。操作陽性對照時必需非常小心不可污染到其它的試驗,可在最後才操作陽性對照。 (c) 分別將瓶內培養液吸除,加入3至5mL的細胞培養液輕輕洗去未感作的病毒,然後再加入細胞維持液3 mL ,置入34℃恆溫箱中培養。最後才可操作陽性對照以避免污染。 (3) 判定: (a) 在顯微鏡下每日觀察是否有細胞病變作用,若有CPE可取病毒液進行電子顯微鏡檢查有無病毒顆粒,或是以牛流行熱標準血清做間接螢光染色法來確認。 (b) 若七天後仍無CPE,培養細胞以-70℃冷凍、再解凍後離心取上清液再以上述步驟五、2.方法,接種新的單層細胞。 (c) 若有CPE可取病毒液進行電子顯微鏡檢查有無病毒顆粒,或是以牛流行熱標準血清做間接螢光染色法來確認。 (d) 若三次繼代後第七天仍無CPE,病材樣品則可認為是陰性。第一代的培養往往無病毒增殖的現象,必須經過2至3次盲目繼代才會顯現病毒增殖的病變。 2. 小老鼠分離病毒與同定: (1) 小老鼠腦內接種: (a) 血球或10%臟器乳劑以胰島素注射用針組(30G)吸取0.03 mL,接種出生一日齡小老鼠,接種位置約耳朵和眼睛中間頭蓋骨中間線偏旁。 (b) 每日觀察症狀,接種的老鼠若呈現神經症狀或是死亡可將老鼠冷凍後,取出腦製成腦乳劑。 (c) 取腦組織方法如下:鑷子夾住老鼠從眼睛向耳後部位的皮膚,並稍微提起後以剪刀剪去頭頂表皮,露出頭骨。以有齒鑷子夾住眼窩大孔,以彎剪沿著大腦區剪去腦殼,露出露出腦組織後以剪刀挖起完整腦組織,置於培養皿內。 (d) 腦製成10%腦乳劑(如上述方法),以4℃,750xg離心20分鐘後,取上清液進行電子顯微鏡檢查有無病毒顆粒或接種細胞。 (2) 株化細胞分離腦乳劑病毒: (a) 以25cm2培養角瓶培養成單層細胞,先以培養液清洗兩次。每角瓶接種0.5mL腦乳劑樣品液到細胞。 (b) 34℃感作1小時。 (c) 去除接種樣品液,以3mL維持液將單層細胞洗1次,再加入3mL維持液至培養瓶,然後放入34℃恆溫箱培養觀察。 (d) 本試驗需含有牛流行熱病毒 (BEFV) 陰性與陽性的對照,但必需非常小心不可污染到其它的試驗。可在最後才操作陽性對照。 (e) 顯微鏡下每天觀察是否有CPE,若有CPE則再用牛流行熱標準血清做間接螢光染色法來確認。 (f) 若7天後仍無CPE,培養細胞以-70℃冷凍、再解凍後離心取上清液,接種新的單層細胞。 (g) 若2次繼代後第7天仍無CPE,樣品則可認為是陰性。 反轉錄聚合酶鏈反應 (reverse transcriptase polymerase chain reaction; RT-PCR) 1. 計設一組具特異性的引子,應用反轉錄聚合酶鏈反應技術可檢測檢測病材中牛流行熱病毒核酸,引子核酸序列如下: 引子1 (BEF-gp1F442),序列為:
5'- GTCCTAATACAACAYAAGCC-3' (正鏈)引子2 (BEF-gp1R1045),序列為:
5'- CTTGCCAACTTGTTTGCTCA -3' (負鏈)引子1和2配對所合成的產物大小為604bp。另外,在這組引子序列內側再設計一組引子,將前組引子合成的RT-PCR產物再利用巢式PCR可提高檢測病毒核酸的敏感性。 引子3 (BEF-gp1F545),序列為
5'- GTCCTCTAAAAGAYATAACC -3' (正鏈)引子4 (BEF-gp1R785),序列為
5'- TATACTCCACCATTCTCCAT-3' (負鏈)引子3和4配對所合成的產物大小為241bp。 2. 病毒核醣核酸 (RNA) 的萃取方法: (1) 取100 μL病材乳劑置於1.5 mL微量離心管中,加入1 mL TRIzol RNA 萃取劑劇烈震盪30秒後靜置室溫5分鐘。 (2) 加入200 μL 氯仿(chloroform)以手壓住微量離心管頂蓋,劇烈震盪15秒後靜置室溫3分鐘。 (3) 於4℃,12,000 rpm,離心15分鐘。 (4) 小心吸取上清液 (約500 μL) 與等量異丙醇(isopropyl alcohol)混合完全後靜置室溫10分鐘。 (5) 於4℃,12,000 rpm,離心15分鐘。 (6) 棄上清液,加入1 mL 75 ﹪乙醇洗去殘留離子後,於4 ℃,12,000 rpm,離心5分鐘後棄上清液。 (7) 經短暫離心後,以10 μL滴管頭將殘餘液體吸乾小心不要攪動RNA沈澱塊。靜置5至10分鐘待乙醇蒸發。 (8) 加入100 μL DEPC滅菌水溶解RNA,若不立即進行RT-PCR反應可保存於-70℃中備用。 3. 反轉錄聚合酶鏈反應: (1) 取一0.2 mL離心管依序加入下項:
反應總體積為100 μL,反應液混合均勻後將離心管置於循環加熱器上。RNA template 10 μL DEPC-DDW 60.6 μL 10X prozyme buffer (protech) 10 μL dNTP (1.25 mM) 8 μL primer 1 (5μM) 5 μL primer 2 (5μM) 5 μL rRNasin (40U/μL ) 0.4 μL AMV Reverse transcriptase (10U/μL) 0.5 μL prozymeTM (1U/μL) 0.5 μL (2) 循環加熱器設定時間和溫度反應條件如下: File 1 : 42℃,40分鐘 File 2 : 95℃ ,1分鐘 File 3 : 94℃,40秒 → 55℃,40秒 → 72℃,40秒35個循環 File 4 : 72℃,10分鐘 File 5 : 4℃保存 (3) 最後產物以1%電泳膠片,分析產物分子量大小約604bp 4. 巢式聚合酶鏈反應(Nested PCR) (1) 取一0.2 mL PCR專用離心管依序加入下項:
反應總體積為100 μL,反應液混合均勻後將離心管置於循環加熱器上。RT-PCR 產物 2 μL DDW 9.5 μL 10X prozyme buffer (protech) 10 μL dNTP(1.25 mM) 8 μL primer 3(5μM) 5 μL primer 4(5μM) 5 μL prozymeTM (1U/μL) 0.5 μL (2) 循環加熱器設定時間和溫度反應條件如下: File 3 : 94℃,40秒 → 55℃,40秒 → 72℃,40秒35個循環 File 4 : 72℃,10分鐘 File 5 : 4℃保存 (3) 最後產物以1%電泳膠片,分析產物分子量大小約241bp 5. 電泳分析 (1) 取出5 μL的100 bpDNA分子量標示預先與2 μL 6倍載入緩衝液混合均勻後注入齒槽洞第一孔中,RT-PCR反應產物或nested-PCR反應產物取出10 μL預先與2 μL之6倍載入緩衝液混合均勻後依序注入齒槽洞中。 (2) 將電極選定為"-"極到"+"極,以100伏特電壓泳動約20分鐘。電泳完畢後將膠片置於UV透視燈下觀察。 (3) 陽性樣品及陽性對照組會出現一條分子量604 bp之RT-PCR產物或241 bp之Nested PCR產物,陰性樣品及陰性對照則無產物出現。每次反應皆須包括一個陰性對照及一個陽對照。陽性對照:RNA template為純化的BEF病毒RNA溶液。陰性對照:不含病毒RNA,以12 μL 蒸餾水代替。 血清學診斷 1. 牛流行熱的血清學診斷方法以中和試驗來比較配對血清(pair serum)力價,第一次是採集急性發熱期病牛血清,經過10至15天再採集發病牛隻血清,進行中和抗體力價測定,以感染期中和抗體力價升高 4倍以上判定為牛隻感染牛流行熱。實施中和試驗的方法如下: (1) 試驗用種毒保存: 測定中和抗體之前先要準備一批試驗用種毒,先小分裝保存於-80℃冰箱中,待每次進行中和試驗時取出稀釋使用。並於每次使用前先測試其病毒力價,以病毒力價達105 TCID50/mL以上方可供為中和試驗使用。 (2) 血清的處理: (a) 將採集的牛隻血清經分裝標示後保存於-20℃。 (b) 於血清測試前,須先經非動化的處理,方法是將已溶解回溫的血清放置在56℃水浴槽,靜置30分鐘,以去除非特異反應因子,然後供為中和試驗用。 2. 中和試驗的方法: (1) 取96孔微量培養盤以細胞培養液做為血清的稀釋液,將血清從原液進行2倍序列連續稀釋至256倍。A1至H1孔先加入50μL稀釋液,取50μL血清樣品加入A1孔混合均勻後,再由A1孔取50μL兩倍稀釋血清加入B1孔混合均勻後,再由B1孔取50μL四倍稀釋血清加入C1孔,連續重覆相同步驟直到H1孔,再由H1孔256倍稀釋血清取50μL丟棄,最後每一孔稀釋血清體積皆為50μL。血清樣品稀釋方式如下:
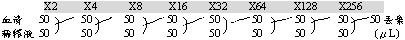
(2) 每個血清至少做2孔A1和A2 (duplicate),每個96孔微量培養盤可以檢測6個血清樣品。 (3) 陽性、弱陽性、陰性血清之序列稀釋液亦需與試驗樣品一同操作,另加一組為未加稀釋血清做毒性對照。 (4) 從-80℃超低溫冷凍櫃中取出牛流行熱病毒株(力價為107.5 TCID50 / mL),待溶解均勻後以細胞維持液稀釋150,000倍約為200 TCID50/mL,力價是否正確,另以病毒的回歸力價測定。 (a) 稀釋血清每孔加入50μL 含有200 TCID50/mL 的牛流行熱病毒,在毒性對照孔則以培養液取代病毒液,細胞對照則是不加樣品血清也不加病毒而加100μL 之培養液替代。血清試驗樣品及陽、陰性對照組的微量培養盤振盪混合均勻後置入34℃,5% CO2培養箱中進行感作1小時。 (b) 感作後,每孔加入50μL 之BHK-21細胞懸浮液濃度為5×105細胞/mL(方法如前述的五、1.(1)步驟),最後繼續置入34℃ 5% CO2培養箱培養3-5天,等待判定。 5. 病毒回歸力價測定: (a) 先製備20、4、2、1、1/2、1/4 TCID50/mL的病毒液。取0.1 mL的200 TCID50/mL 稀釋病毒液加到0.9 mL的細胞培養液稀釋成20 TCID50/mL ,於試管振盪器上充分混勻,再取0.2 mL的20 TCID50/mL病毒液加入0.8 mL細胞培養液即成4 TCID50/mL ,經充分混勻後,再取0.5 mL的4 TCID50/mL病毒液加入含0.5mL細胞培養液即成2 TCID50/ mL,再依相同步驟連續稀釋二次完成1、1/2及1/4 TCID50/mL的病毒液。 (b) 從各濃度之稀釋病毒液(100、20、4、2、1、1/2、1/4 TCID50/mL)中取50μL加入含50μL細胞培養液的病毒回歸力價對照盤,每濃度之稀釋病毒液分別加入四孔內。並同時與血清試驗樣品及陽、陰性對照組的微量培養盤振盪混合均勻後置入34℃,5% CO2培養箱中進行感作1小時。每孔加入50μL 之BHK-21細胞懸浮液濃度為5×105細胞/mL,最後繼續置入34℃ 5% CO2培養箱培養3-5天。計算四孔中有幾孔產生細胞病變現象 (CPE),作為計算病毒回歸力價的測定依據。 (c) 從顯微鏡下觀察CPE,檢查病毒的回歸力價測定是否為200/mL TCID50 (30~300 log10 TCID50均可接受) 、並檢查陽、陰性血清對照和細胞對照組。陽性血清對照應在2倍序列稀釋的±1稀釋度範圍之內( ±0.3單位),弱陽性對照檢驗結果應為陽性,陰性血清應該沒有中和力價,細胞對照組其細胞應完好不變。 (d) 血清的力價以可完全中和病毒的血清稀釋倍數之倒數表示。任何力價高於2可判為陽性,若血清對照顯示有毒性,則樣品判定為沒有結果,而須重新測試,或血清重新採集一次以供測試,這樣的情形在血清抗體力價高時可用更高的稀釋度做血清毒性對照再來判定。 病毒中和試驗 (Virus neutralization test) 試驗用種毒保存和血清的處理方式同七、(1)(2)所述。試驗方法可以參考血清中和試驗,步驟如下:1. 取96孔微量培養盤以細胞培養液做為血清的稀釋液,將待測血清從原液進行2倍序列連續稀釋至256倍。最後每一孔稀釋血清體積皆為50μL。每個血清至少做2至4孔,每個96孔微量培養盤可以檢測3至6個血清樣品。 2. 對照組包括已知抗體力價的標準對照血清、陰性對照血清、培養基對照、細胞對照和病毒迴歸試驗。 3. 每孔加入50μL 200 TCID50/mL 的牛流行熱病毒後,置入34℃,5% CO2培養箱中進行感作1小時。 4. 每孔加入50μL 之BHK-21細胞懸浮液濃度為5×105細胞/mL,最後繼續置入34℃ 5% CO2培養箱培養3-5天,等待判定。 5. 判定方法如上述,當力價大於或等於1/4血清稀釋倍數認定為抗體陽性。 間接螢光抗體試驗(Indirect fluorescent antibody test) 1. 分別將疑似感染牛流行熱病毒和無感染任何病毒之BHK21或Vero細胞塑膠培養瓶,以前述之細胞消化方式五、1.,作成細胞懸浮液濃度約為5×105細胞/亳升,然後分別在一玻片上滴一小滴,塗抹開後風乾。 2. 分別置入不同的固定槽內,固定槽內加滿-20℃丙酮,固定細胞約10 分鐘後,放置一旁令其自然風乾,若不馬上染色壓片可收集於-70℃保存以維持其抗原性。 3. 牛流行熱標準血清先以食鹽緩衝液適當稀釋後(必須先評估測試其最適當的反應濃度),分別滴於牛流行熱病毒感染細胞抹片和未感染對照細胞至可覆蓋抹片為止。 4. 抹片置於37℃濕式恆溫箱內感作30分鐘。 5. 抹片以磷酸緩衝鹽溶液 (PBS) 洗滌數次後,面朝下輕輕地以衛生紙吸除水份。 6. 兔抗牛免疫球蛋白IgG螢光標示抗體以PBS稀釋100倍(每瓶螢光標示抗體,必須先評估測試其最適當的反應濃度,並避免反覆冷凍解凍,使蛋白質變性而凝集)。分別滴於牛流行熱病毒感染細胞抹片和未感染對照細胞至可覆蓋抹片為止。 7. 抹片置於37℃濕式恆溫箱內感作30分鐘。 8. 抹片以磷酸緩衝鹽溶液(PBS)洗滌數次再以蒸餾水清洗一次,面朝下輕輕地以衛生紙吸除水份然後滴上一滴磷酸緩衝溶液/甘油混合液,蓋上蓋玻片後於螢光顯微鏡下鏡檢。 9. 判讀時先觀察無感染病毒的陰性對照玻片,再觀察感染病毒的陽性玻片,陽性細胞抹片呈現特異性螢光,而其他均需為陰性。 參考文獻: 1. 邱仕炎、呂榮修(1987) 牛流行熱預防的研究. 中華民國獸醫學會雜誌,13:189-185. 2. 呂榮修、李永林、黃士則、蔡向榮、廖永剛、林地發、曾俊憲、邱仕炎 (1992) 1989年發生在臺灣的牛流行熱疫學研究. 臺灣畜牧獸醫學會會報,60: 51-56. 3. Chiu S.Y. and Lu Y.S. (1987) The epidemiology of bovine ephemeral fever in Taiwan 1984. J. Chinese Soc. Vet. Sci., 13:1-9. 4. Davis S.S., Gibson D.S. and Clark R. (1984) The effect of bovine ephermal fever on milk production. Aust. Vet. J., 61:128. 5. St. George T.D (1985) Studies on the pathogenesis of bovine ephemeral fever in sentinel cattle.Ⅰ.Virology and serology. Vet. Microbiol., 10:493-499. 6. St. George T.D. and Standfast H.A. (1988) Bovine ephemeral fever. In: Thomas P. Monath (Ed.) The Arboviruses: Epidemiology and Ecology Vol.Ⅱ Chapter 17, CRC Press, Inc. Florida, U.S.A. pp.71-86. ◎ 診斷流程圖 ◎

1. 血清學試驗: 病材:配對血清 (paired sera)
方法:中和抗體力價測定,感染期中和抗體力價升高 4倍以上判定為牛隻感染牛流行熱。2. 病毒分離: A. RT-PCR檢驗 B. 病毒分離 病材:血球、臟器
方法:(1) 接種哺乳鼠 (2) 接種BHK細胞株、Vero細胞株、Hmlu細胞株 3. 病毒確認: 間接螢光抗體試驗、病毒中和試驗
