| 11.1. |
免疫血清製造法 |
| 11.1. |
1.平滑型與粗糙型菌落之鑑別法 |
| |
免疫血清使用之細菌必須要使用平滑型細菌,茲列述平滑型 (S 相 ) 與粗糙型 (R 相 ) 菌落之鑑別要領。
| 1. |
菌落之外觀:S 相菌之邊緣與表面平滑,透明度 S 相較高。 |
| 2. |
肉羹培養:S 相菌均勻溷濁,R 相菌時,菌沈澱積存在管底而上清透明,中間之 SR 相菌有時均勻溷濁,也有沈澱時。 |
| 3. |
自發凝集:菌液放在小試管,放置 37℃ 2 小時,觀察有無凝集,R 相菌會引起自發凝集。 |
| 4. |
Trypaflavin 反應,用 0.2% Trypaflavin,在玻片上做凝集反應,R 相會凝集,S 相不會反應。 |
| 5. |
SR血清之凝集反應:做 S 及 R 相免疫血清,依此血清判別 S 相或 R 相菌。 |
平滑型菌株保存上之注意:菌株保存上必須維持平滑型狀態,菌分裝後即冷凍乾燥,如要以培養基繼代時,由肉水製備加 2-2.5% 之稍軟之瓊脂做高層培養基,以 S 相菌穿刺培養後,加一層滅菌流動石臘,有時播種在平皿瓊脂上,挑揀 S 相菌以斜面培養供為試驗,繼代時仍繼續在半流動高層培養基。 |
| 11.1. |
2.明礬佐劑 (Alum Adjuvant) 之免疫法 (舉例) |
| |
| 1. |
準備:
| (1) |
三角燒瓶 (200ml),吸管類。 |
| (2) |
注射器。 |
| (3) |
鉀明礬 ( 特級 ) 之 10﹪溶液,濾過滅菌。 |
| (4) |
5% NaOH |
| (5) |
滅菌生理鹽水 |
|
| 2. |
免疫抗原之製備:
| (1) |
含有蛋白性抗原 1.5mg/ml 溶液 100ml。 |
| (2) |
加 10% 鉀明礬 5-100 ml 會產生白濁沈澱。 |
| (3) |
假如不產生十分之白濁沈澱時,一滴一滴約加入 5% NaOH,提高 pH 至 6.5,充分放置使其產生沈澱。 |
| (4) |
棄上清液,以滅菌生理鹽水復原至原量,再浮游後供為免疫注射之用。 |
|
| 3. |
免疫注射法(例):
| (1) |
1ml 之免疫抗原間隔 1 日接種於皮下,腹腔或肌肉內。 |
| (2) |
增量至 1.5ml,同樣注射 3 次。 |
| (3) |
增量至 2.0ml,同樣注射 4 次。 |
| (4) |
增量至 3.0ml,同樣注射 4 次。 |
| (5) |
增量至 5.0ml,同樣在 7 日內 2 次注射。 |
| (6) |
由最後注射至 5-7 日後試驗採血。 |
|
|
| 11.1. |
3.各種免疫血清之製備 - 免疫過程實例 |
| |
| 1. |
Salmonella 0 免疫血清 - 家兔
以 S 型菌在 Broth 培養 20 小時後,在 100℃ 加熱 2 小時,然後加 0.6﹪Formalin 生理鹽水,再加等量死菌懸浮液為免疫原,以 4 日間隔免疫 4 次,第 1 次 0.5ml,第 2 次 1.0ml,第 3 次 2.0ml,第 4 次 3.0ml,均接種靜脈內,第 4 次免疫注射後至 5-7 日,如 0 抗體價達 1:800 以上時,全採血。 |
| 2. |
Salmonella H 免疫血清 - 家兔
在半流動培養基確認運動性活潑之沙氏桿茵,在肉羹培養 20 小時後,如等量之 0.6% Formalin 鹽水,並置 37℃ 恆溫箱 1 夜殺菌後供為免疫原。以 4 日間隔 4 次注射,第 1 次 0.5ml,第 2 次 1ml,第 3 次 2.0ml,第 4 次 3.0ml,均靜脈注射,第 4 次注射後 5-7 日試血,如抗體價有 1:800 以上時,全採血。 |
| 3. |
病原性大腸菌免疫血清 - 家兔
在普通瓊脂培養 20 小時後加 1% 明礬,處理後供為免疫原,以 80-100mg 注入靜脈內 1 次,7-10 日後試血,K 抗體價如有 1:800 以上,全採血。
若不想要含 H 抗體之血清時,菌液加 3 倍量之藥局方酒精,放置室溫 2 小時,經破壞 H 抗原後,所遠心之菌體以生理鹽水懸浮遊後,再用明礬處理為免疫原。 |
| 4. |
抗 Influenza Virus 免疫血清 - 天竺鼠
感染病毒尿囊液以 10-2 -0.1ml 經鼻接種,經過 5-8 週後,再以 S 抗原 1.0ml 腹腔內接種,1 週後採血抗體價約 64-128 倍。
如加佐劑抗原者,第 1 次 2.0ml 肌肉注射,4 週後再以 S 抗原 2.0ml 腹腔內,7 日後再接種 S 抗原 2.0ml 於腹腔內,經 7 日後採血,抗體價約 128 倍。 |
| 5. |
抗日本腦炎免疫血清 - 小白鼠、天竺鼠
感染小白鼠腦乳劑以 1 萬倍稀釋液 0.2ml 腹腔內注射,5-7 日後以 10 倍稀釋液 0.2ml 腹腔內注射,5-7 日後 10 倍稀釋液 0.2ml 於腹腔內,再以 5-7 日後 10 倍稀釋液 0.2ml 於腹腔內,5-7 日後仍以 10 倍稀釋液 0.2ml 接種於腹腔內,經過 7-10 日後採血,抗體價約 80 倍。 |
| 6. |
抗人腺病毒免疫血清 - 家兔
病毒 0.3ml (MK) 靜脈注射,5-7 日後 5ml 靜脈注射,5-7 日後靜脈注射 10.0ml 病毒,5-7 日後 10.0ml 靜脈注射,5-7 日後 20.0ml 靜脈內注射,7-10 日後採血抗體價 256 倍左右。 |
| 7. |
抗狂犬病病毒免疫血清 - 家兔、天竺鼠
感染兔或天竺鼠腦 10 倍乳劑以紫外線不活化,加油性佐劑為抗原,最初以 3.0 ml 肌肉注射,經 1 個月後 2 次間隔 7 日各 1.0ml ( 不加佐劑 ) 腹腔內注射,7-10 日後採血。 |
| 8. |
抗新城雞瘟病毒免疫血清 - 家兔
強毒新城雞瘟病毒佐藤株感染尿液 ( 病毒價 109.0 EID50) 第 1 次以 4ml 靜脈注射,以後每隔 7 日接種於家兔腹腔內,經 4-6 週後能 log6.0 以上之中和抗體。 |
| 9. |
抗雞勞氏肉瘤 (Rous Sarcoma) 病毒免疫血清 - 鴿
Schmidt-Ruppin 毒株接種於鴿翼膜皮內,所引起之肉腫以 Gelatin Veronal 緩衝液做 20% 乳劑,加Hyaluronidase 2u/ml,在 4℃ 30 分鐘靜置後,3,000rpm 離心 10 分鐘,上清液接種於成熟鴿翼膜皮下 1ml,經 5-6 週全部採血。 |
|
| |
|
| 11.2. |
凝集反應 (Agglutination test) |
| |
呂榮修、蔡向榮
|
| |
細菌之凝集反應,通常有平板凝集反應 ( 試探性凝集反應 ) 及試管內凝集反應兩種,前者以菌液或血球等之抗原與相對免疫血清,在玻璃片上所混合反應之定性的方法,此法應用於對已分離之細菌之同定,或抗體之證明,尤其被廣用於沙氏桿菌血清反應之用。一般在家畜疾病田間診斷上,應用於雛白痢、布氏桿菌、CRD 等疾病。後者在試管內以種種稀釋之免疫血清與一定量之抗原進行反應之定量方法,使細菌鑑定,及抗體方價 ( 凝集素價 ) 測定結果更為正確。 |
| 11.2. |
1.急速平板凝集反應 (Rapid slide agglutination) |
| |
| 1. |
菌液:使用時如以充分搖動,使內容菌液均勻。 |
| 2. |
器具及其他:反應用玻璃板、0.1-0.2ml 吸管、攪拌棒、紗布、平皿、生理鹽水、採血器具、2-3% 石碳酸水、筆記本。 |
| 3. |
玻璃器具:玻璃板用肥皂水充分洗滌後,再水洗,乾燥後使用,如使用時濕氣未乾會引起血清或菌液擴散流佈至鄰域。本反應所使用之吸管精細,內徑又狹窄,常會引起先端破損或堵塞。如使用多例被檢血清時,在使用後以流水沖洗 ,然後通過酒精→乙醚,以去掉水分。 |
| 4. |
反應條件:反應之出現受溫度之影響很大,無論在夏天或冬天以能在 20-25℃ 之下進行為最理想。在戶外實施時,如受日光直射即易乾燥,又風大,塵埃多時亦以判定成績,故皆應避免之。 |
| 5. |
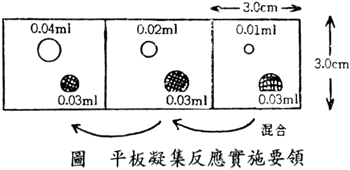
實施方法
| |
(1)使用 0.1ml 之吸管,在玻璃平板之一區域,滴下下列抗血清 0.08,0.04,0.02,0.01,0.005ml,對照置生理鹽水。 |
| (2) |
加菌液 0.03ml,不要接觸血清滴放在一旁。 |
| (3) |
以清潔之攪拌棒由 0.005ml 至 0.01,0.02… 依序混合,該混合物大約等於 1:25,1:50,1:100,1:200 及 1:400 之血清稀釋倍數。 |
| (4) |
玻璃板前後左右傾斜混合,依所示時間內判定成績。
 |
|
|
| 11.2. |
2.試管凝集反應 (Tube agglutination test) |
| |
| 1. |
排列 10 支小試管,以倍數稀釋法由 1:5 - 1:2560 稀釋之抗血清各 0.5ml,第 11 支為對照試管加 0.5ml 之生理鹽水。 |
| 2. |
各試管加抗原液 (1-2mg/ml) 0.5ml。 |
| 3. |
內容充分混合,在 37℃ 靜置 2 小時後,移置冰室 1 夜後,判定成績。 |
| 4. |
強陽性反應時,菌凝集在管底,上部即變透明,如經振動時可看見菌之凝集顆粒,如不凝集時,液體均一漍濁,判定時依凝集程度表示, 、卅、廾、十記號。如表示十即血清之最終末稀釋倍數或其血清之凝集素力價。 、卅、廾、十記號。如表示十即血清之最終末稀釋倍數或其血清之凝集素力價。 |
|
| 11.2. |
3.血球凝集抑制 (HI) 反應實施要領 |
| |
| 1. |
準備
| (1) |
0.85% 生理食鹽液 ( 食鹽液 ):即 8.5g 之 NaCl 溶解於精製水 1,000ml。 |
| (2) |
Alsever 液 ( 葡萄糖 2.05%;枸櫞酸鈉 0.80%;食鹽 0.42%;枸櫞酸 0.055%)。 |
| (3) |
抗原原液
市售之乾燥抗原 1 安培或玻璃乾燥瓶,此時安培被封閉於減壓下,其尖端先用鑪鋸開一小孔,使其壓力復原後再開大安培。測定抗原之使用量 1 小時前以食鹽液溶解並調製後保存於冰室。 |
| (4) |
器材之準備
100 及 1,000ml 容量之液量器、注射器、0.5ml 及 2ml 之吸管、最小試驗管、遠心器、反應板、試驗管臺、紗布、濾斗、奇異墨水。 |
| (5) |
紅血球浮游液之製造
先取約欲採取血量 1/4 之 Alsever 液於注射器內,由雞之翼靜脈採血,混合均勻防止凝血後放入容器內。Alsever 抗凝血液如為無菌,在冰箱 (4℃) 保存可使用 1 星期之久。該血液約加 5 倍量之食鹽液,用遠心器反覆洗滌 3 次。即先以回轉數約 2,000r.p.m. 5 分鐘遠心,洗滌 2 次後之沈渣血球以食鹽液還原為原量,再以 1,500r.p.m. 遠心 10 分鐘,此沈渣血球以食鹽液再浮游為 0.5% 紅血球濃度。該血球如保存於冰箱 3 日內尚能使用,但已溶血者不宜使用。 |
|
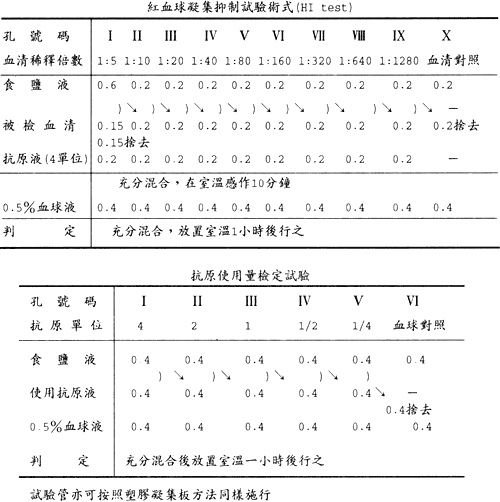
| 2. |
抗原之使用量測定
| (1) |
血球凝集板 ( 反應板 ) 第 1 列之各孔 (1-10 孔 ) 加 0.4ml 之食鹽液。 |
| (2) |
最小試驗管內分注食鹽液 0.9ml 及抗原液 0.1ml 使成 10 倍稀釋抗原液。 |
| (3) |
第 1 孔加 10 倍稀釋抗原液 0.4ml。第 1 孔之內容以 0.5ml 容量之吸管充分混合,然後移 0.4ml 於第 2 孔。第 2 孔亦同樣操作後再移 0.4ml 於第 3 孔之方法如此行至第 9 孔,第 9 孔之 0.4ml 除去。第 10 孔不動 ( 做食鹽液對照 ),如此做成 20 倍至 5120 倍間之 2 倍階段稀釋。 |
| (4) |
血球液各孔加 0.4ml |
| (5) |
反應板充分振盪使血球混合後置於定溫 (15-25℃) 1 小時後判定結果於管底所形成之凝集像。
 |
| (6) |
判定
| (a) |
如 i 廣佈於管底全面之淡紅色凝集像即記載為 (+) |
| (b) |
如 iii 管底血球沈澱如日出狀 ( 日本國旗狀 ) 即記載 (-) |
| (c) |
(+) 與 (-) 之中間。如 ii 紅血球之輪廓模糊不明,其周圍呈暈狀之凝集即記載 (±)。 |
|
| (7) |
本反應所使用抗原稀釋倍數之決定示 (+) 凝集抗原之最高稀釋倍數即其終末點濃度為 1 單位,抑制試驗用 4 單位之抗原量。譬如終末點為 640 倍,該抗原之 640 倍稀釋液 0.4ml 有 1 單位之凝集素,4 單位時變成 160 倍稀釋之 0.4ml。但是抑制試驗使用之抗原量並非 0.4ml 係 0.2ml,故要做 4 單位 0.2ml,必須做 2 倍濃厚液,即作 80 俗稀釋液 (8 單位 ),使用其 0.2ml 即可。 |
|
| 3. |
紅血球凝集抑制試驗 (HI test)
| (1) |
反應板第 2 列之第 1 孔加 0.6ml,由第 2 孔起每孔各加 0.2ml 之食鹽液。 |
| (2) |
以 0.5ml 容量吸管取 0.15ml 之血清加於第 1 孔充分混合後,依此分注 0.2ml 於第 2 孔及第 10 孔,然後除去 0.15ml。因此第 1 孔可留下 0.2ml 之 5 倍稀釋血清。第 2 孔之內容充分混合後,移 0.2ml 於第 3 孔,再由第 3 孔同樣把 0.2ml 移於第 4 孔之步驟行至第 9 孔,第 9 孔之 0.2ml 除掉。第 10 孔原封不動 ( 血清對照 ) 如此得成 5 倍至 1280 之血清 2 倍階段稀釋。 |
| (3) |
各孔加上記 (7) 抗原 ( 抗原使用量測定求得之倍數稀釋抗原原液各 0.2ml 含 8 單位 ) 後,反應板小心搖動使內容混合。 |
| (4) |
放置室溫約 10 分鐘後,如抗原使用量測定時所用之血球液 0.4ml 充分混合,置室溫 1 小時。 |
| (5) |
為檢討使用抗原是否適當量應同時設置抗原對照。做使用抗原之 2 倍階段稀釋列。即 5 孔各注入 0.4ml 食鹽液,然後加使用之抗原 0.4ml 於第 1 孔,內容混合以 0.4ml 移於第 2 孔,如此稀釋至第 5 孔,即第 1 孔之 0.4ml 中抗原之實量為 0.2ml,即與反應所使用同樣為 4 單位之凝集素,第 2 至第 5 孔依序為得 2,1,1/2,1/4 單位。 |
| (6) |
設血球對照,即另在 1 孔加食鹽液 0.4ml 與血球液 0.4ml。 |
| (7) |
1 小時後判定管底像,完全抑制凝集像 (-) 孔之最大稀釋倍數為血清之力價。 |
抗原對照如使用量適當該第 3 孔 ( 即 1 個單位之凝集價 ) 亦應完全凝集為是。 |
| |
 |
|
| 11.2. |
4.HA HI 微量試驗方法 Microtiter 法 |
| |
Microtiter 法,在 1950 年由匈牙利之 Takatsy 所創立,爾後經 Server (1962) 所改良,本法因具有最大之優點,乃只需試管使用量 1/3-1/10,且 1 次能檢查多數之試驗品 (8-12),因此本法被廣為應用。
| 1. |
稀釋棒 ( Micro diluter):以 Cooke 製最能信賴,準備 8 支 0.025ml 就夠用。 |
| 2. |
滴下針 ( Micro dropper):HI 試驗時有 0.025ml 2 支,0.05ml 1 支即能應用如。 |
| 3. |
96 孔微量盤 (Microplate):有 U 型及 V 型兩種,普通 HA,HI 試驗時使用 V 型,CF test 使用 U 型,但鳥類 ( 雞、鵝 ) 之紅血球是有核紅血球較重,HA(+) 凝集膜會收縮,此時改用 U 型較佳。 |
| 4. |
混合器
稀釋要領
| (1) |
除微量盤之第 1 孔以外,各孔各加稀釋液 0.025ml。 |
| (2) |
第 1 孔加檢查材料 0.05ml [ 用超微量吸管 (0.05ml) 或 0.2ml 之微量吸管 ],如使用 Sanz 吸管 (Beckman 創造 ) 更方便。 |
| (3) |
浸在精製水之稀釋棒拭乾,以吸水紙 ( 衛生紙亦可 ) 全面吸乾稀釋棒。 |
| (4) |
把稀釋棒之上端拿齊一,放在第一孔。 |
| (5) |
稀釋棒垂直立起,上端合齊靠攏,以雙手少許捻轉,使稀釋棒攪拌 (8 支中如 1 支彎曲時,無法圓滿進行 ),攪拌時不能起泡沫,攪拌時所持之稀釋棒不可向下施壓力。 |
| (6) |
齊拿之稀釋棒夾在兩拇指間,拇指與第 2 指之間隔放開,稀釋棒之端夾在兩手手掌內固定,此時調整呼吸 ( 統一精神 )。 |
| (7) |
保持 (6) 之狀態,垂直拿起稀釋棒 ( 不可觸及孔側壁 )。 |
| (8) |
依序同樣操作 (2 倍階段稀釋 )。 |
| (9) |
最後做完之稀釋棒放進 0.5﹪次亞鹽素酸納 (Sodium Hypochlorite Solution) 溶液 1 分鐘消毒。 |
| (10) |
擦拭附著稀釋棒之液體,準備兩個燒杯蒸餾水,在第1個燒杯沖洗後移至第 2 燒杯蒸餾水內,由此再作其次材料之稀釋。 |
目前微量血球凝集試驗 (HA) 及血球凝集抑制試驗 (HI) 亦有用 8 孔或 12 孔的微量多孔稀釋器 (Multichannel pipette,如 Flow 之 Titertek) 配合可替換之微量滴頭 (micro pipette tip) 使用,微量滴頭可高壓蒸氣滅菌,價廉,可一次大量準備供為替換用,因此不必如稀釋棒每稀釋一個樣本後即需立即清洗消毒才能再作下個樣本之稀釋,在進行大量樣本測定時十分方便,並且吸取及添加量依試驗設計而調整有 50-200μl,5-50μl 等不同範圍之多孔稀釋器可供選用,目前已成為一般試驗室進行 HA 及 HI 試驗之常用配備,有些試驗室甚至還有全自動或半自動之微量吸管及稀釋器 (automated micropipette 及 microdiluter) 可在 96 孔微量盤內進行稀釋液之添加及血清之稀釋等。 |
|
| |
|
| 11.3. |
沉降反應 (Precipitation test) |
| |
呂榮修、蔡向榮
|
| |
某些傳染病之臟器,組織或滲出物等材料與免疫血清之間常能引起沉降反應, 如氣腫疽、豬丹毒、馬流產、牛肺疫、炭疽等,但本診斷法須要常備高力價之免疫血清頗為不方便,且近年來細菌學診斷法之急速進步,故現僅炭疽之 Ascoli 反應仍應用於野打外之診斷。不過沉降反應對菌之型別分類,菌體成之分析等之研究至目前仍認為係極重要之血清反應。 |
| 11.3. |
1.炭疽:Ascoli 反應 |
| |
| 1. |
器材:沉澱管、毛細吸管、石綿、5ml 注射器、試驗管、水浴槽、炭疽沉降素血清。 |
| 2. |
沉降原:被檢材料 ( 脾臟或血液 ) 取 1-2g 於試管以鑷子或小剪刀細挫,然後加 5 倍量之生理鹽水,把試管材料於沸湯中加熱至所析出呈微黃色透明液,約需 20-30 分鐘。 |
| |
以煮過之少量石棉塞住注射器之先端,以生理鹽水洗過,然後將臟器之加熱浸出液通過石綿層,即能得透明之液體。 |
| 3. |
反應試驗:普通先將沉澱素血清以毛細管吸引入毛細管約 5-6mm,然後另用毛細管吸取上面之濾液重壘於血清上面其量與血清量相等,此時以左手拿有血清之試管,右手封住毛細管口插入試管內輕置血清上面,順其管壁略提高輕放浸出液,該液能沿其血清通過之路而流下,即血清與沉澱原之接觸面不混合其接觸面能成為直線。 |
| 4. |
判定:如能置孵卵器則反應出現較速,但普通置室溫 15 分鐘,如陽性者在 5-6 分鐘以內呈現明顯之白濁輪。 |
注意:
| (i) |
要置對照如被檢材料與健康血清,炭疽菌浸出液與沉降素。 |
| (ii) |
死後腐敗過度有類屬反應之出現,飼料、皮革等被檢材料常有此現象,類屬反應,多在重層後經過 10-20 分鐘以上才出現,並且反應之白濁輪並非直線,厚且界線不明。有類屬反應者,可試用酸性加熱抗原。 |
| (iii) |
如材料以 Formalin 或甘油浸漬者,在 1 個月內尚能供為 Ascoli 反應用。 |
|
| 11.3. |
2.瓊脂沉降反應 |
| |
免疫擴散法 (Immunodiffusion techniques) 乃抗原或抗體在支持體 ( 如瓊脂 ) 中能擴散,以人為的方法使抗原與抗體之濃度比例所形成沉降物在最適合之條件之位置上出現沉降線,並可以肉眼觀察之抗原抗體反應,且研判抗原液中具有能與抗體反應之抗原決定位,具有一定之化學構造之抗原決定 ( 決定抗原之特異性基 ) 之分子有幾種,因此抗血清中也持有相對應之抗體分子能形成與其同數之沉降帶,因此成為對蛋白質、多糖體等有抗原性物質之分析上不可缺少之方法。 |
| |
| 1. |
Oudin 法
| (1) |
準備
| a. |
器具
| (a) |
小試驗管內徑約 3㎜ 長 6㎝ |
| (b) |
試驗管台,排一列時能從管看到 3-4㎝ 高者較佳。 |
| (c) |
普通吸管,毛細吸管 56℃ 之水浴槽。 |
| (d) |
石蠟膜。 |
|
| b. |
試藥
| (a) |
粉末瓊脂 (Difco Noble,Agar-EPI,agarose,Behrin-gwerke Rein-Agar,Jagar) |
| (b) |
PBS,PH7.0 左右。 |
| (c) |
agar gel:1 克放入三角燒瓶,此加 PBS 100ml 在 100℃ 加溫溶解立即能使用,同時加防腐劑 NaN3 0.1%。 |
| (d) |
抗血清及抗原。 |
|
|
| (2) |
做法
| a. |
1% agar gel:在 100℃ 中完全溶解,以吸管抽 1ml 於小試管,置 55℃ 水溫槽。 |
| b. |
溶解之瓊脂降至 56℃ 時 ( 約 10 分鐘 ) 加 1ml 之抗血清充分混合。 |
| c. |
以吸管吸取混合液放於小試管,其高度約 2.5-3㎝,置室溫使其凝固。 |
| d. |
抗原液保持液狀重層於抗血清層,量與抗血清同量。 |
| e. |
小試管口以石臘膜或橡皮粘上密封,置 37℃ 恆溫箱。 |
| f. |
翌日開始每日觀察,觀察其所形成之沉降輪之數及移行於下方之狀況。 |
|
| (3) |
試驗之秘抉
| a. |
要放進抗血清瓊脂於小試管之吸管,須以在 56℃ 加溫之 PBS 中多次吸進放出使其保溫。 |
| b. |
小試管也保溫於 56℃ 之水浴中,抗血清放進後暫時浸浴於 56℃ 之水溫槽中即能使管壁附著之抗血清流落,看抗血清流下後即取出於室溫使其凝固,在瓊脂要凝固時加少量之 PBS 能使液面不致凹陷而能成為水平,瓊脂凝固後再將 PBS 抽棄。 |
| c. |
抗原濃度如過低,最好抗原層也以瓊脂混合,但大卻份抗原量總比抗體量多,因此抗原能擴散於抗血清層。 |
| d. |
抗血清中之瓊脂濃度以瓊脂製品及反應系有些差異,普通以 0.25-0.5% 為最佳。 |
|
|
| 2. |
Oakley法
| (1) |
準備
| a. |
器具
| (a) |
小試管,( 內徑 2-3m,長 6㎝) |
| (b) |
試驗管台。 |
| (c) |
普通吸管,56℃ 之水浴槽。 |
| (d) |
石蠟膜。 |
|
| b. |
試藥
| (a) |
精製瓊脂粉末 (Difco) Noble,J agar ( 日本三光 ) |
| (b) |
PBS ( PH7.0 左右 )。 |
| (c) |
Agar gel 之瓊脂 1 克置於三角燒瓶內加 100ml 之 PBS 在 100℃ 加溫溶解,並加 0.1% NaN3 防腐。 |
|
|
| (2) |
實際做法
| a. |
抗血清瓊脂溶液,抗原瓊脂溶液,0.5% 瓊脂溶液之配製:取 3 支內含 1% 瓊脂保溫於 56℃ 中之試管,然後各加等量之抗血清,抗原及 PBS,充分混合後保持於56℃。 |
| b. |
抗血清瓊脂溶液依 Oudin 法之要領分注於小試驗管約 2㎝ 高。 |
| c. |
重層 0.5 % 瓊脂,高約 2㎝,在室溫凝固。 |
| d. |
再使小試管浸入 56℃ 恆溫水浴槽,管壁立即升溫,然後加抗原瓊脂溶液 2㎝,在室溫凝固。 |
| e. |
管口以石蠟膜封閉,放入 37℃ 恆溫箱中。 |
| f. |
次日開始觀察,在中間瓊脂層所形成之沉降輪。 |
註:抗原層使用液體亦可。 |
|
| 3. |
Oucheterlony法
本法簡單,且不僅能檢出抗原及抗體亦能供同定之用。
| (1) |
準備:
| a. |
Agar gel 之製備:
瓊脂 (J-Agar,Difco Noble,Agar-EpI,Ionagar,Agarose 等 ) 粉末溶解於 1-1.2% PBS,加 0.1% NaN3 或以 1.5% 添加瓊脂 0.003% Methyl orange,溶解使以 110℃ 10 分鐘滅菌。
另 1 個方法即 0.9% 之生理鹽水加石碳酸 2.5g 及 Methyl orange 30mg 溶解後以橡皮塞密封在室溫保存,使用時取 10ml 之保存液加 0.9﹪之生理鹽水 90ml 及 Bacto agar 0.8g 加熱溶解。
|
| b. |
5.5㎝ 之平皿或載玻片 ( 或玻璃板 ) |
| c. |
使用玻璃板 ( 載玻片 ) 時要用塑膠箱 ( 密封 ) |
| d. |
抗血清,抗生素來定用之鑄型 ( 金屬鐶 ) 或直徑 2-3㎜ 之穿孔器或在方眼紙畫各管之距離有 3㎜ 之圓形。 |
|
| (2) |
實施方法:
| a. |
使用玻璃板 ( 片 ) 之方法 (Micro-Ouchterlony 法 )。
| (a) |
玻璃板 ( 片 ) 以重鉻酸鉀硫酸液洗滌,水洗並以酒精脫脂。 |
| (b) |
置於水平。 |
| (c) |
加瓊脂溶液 (Agar gel) 厚約 1㎜,如玻片以 2ml 為適當能流至玻璃全面,以吸管弄平。 |
| (d) |
使其靜止凝固。 |
| (e) |
凝固後以穿孔器打孔或置方眼紙所畫之圓形上以棒管 ( 外徑 2-4㎜ 薄製玻璃管 ) 穿孔。 |
| (f) |
以針尖除去瓊脂。 |
| (g) |
分裝抗原,抗血清,分裝量至孔滿為止,如要分注一定量時約 4μl 程度為宜。 |
| (h) |
放入塑膠箱,箱底舖以浸水之紗布,置同高之棒,上面放玻璃板。 |
| (i) |
密閉,置於 37℃ 之恆溫箱或室溫 ( 冰室 )。經過 30 分鐘後每隔 30 分鐘取出觀察。 |
|
| b. |
使用平皿法:
| (a) |
溶解之瓊脂放入平皿,離底面之厚約 1-2㎜,在室溫使其凝固。 |
| (b) |
凝固後置鑄型 ( 或抗生素檢定用之金屬 CUP)。 |
| (c) |
再加瓊脂溶液約 3-4㎜,此時如不迅速注入會引起瓊脂之不平衡。 |
| (d) |
在室溫使其充分凝固在 ( 在室溫 15℃ 約 30 分鐘 )。 |
| (e) |
凝固後取出鑄型 ( 金屬 CUP)。 |
| (f) |
如孔中留有瓊脂者以鑷子取出。 |
| (g) |
抗血清及抗原液依照計畫注入至滿為止。 |
| (h) |
加蓋後保存於 37℃ 或室溫 ( 冰室 ),總之要保持一定之溫度。 |
| (i) |
每日觀察反應之出現至 7-10 日為止。 |
|
|
|
|
| |
|
| 11.4. |
補體結合 (Complement Fixation) 反應 |
| |
呂榮修、蔡向榮
|
| 11.4. |
1.稀釋液 |
| |
| (1) |
Mg生理食鹽水 (Kolmer 之生理鹽水,Mgs)
| MaCl |
8.5 g |
| MgCl2.6H20 |
20.3 g |
| 再蒸餾水 |
1,000 ml |
| 此係 1/10mol Mgs 原液。 |
|
| 使用時 Mgs stock |
10 ml |
| 生理鹽水 |
990 ml |
|
| (2) |
| NaCl |
8.5 g |
| 硫酸鎂 |
0.1 g |
| 蒸餾水 |
1000 ml |
| 120℃ 20 分鐘滅菌 |
|
|
| (3) |
Veronal 緩衝生理鹽水
| NaCl |
85.0 g |
| 5, 5-diethyl barbituric acid |
5.75 g |
| Sodium 5,5-diethyl barbiturate |
3.75 g |
先以 barbituric acid 用 500ml 加溫之蒸餾水溶解,然後加 NaCl 與 barbiturate 總量做 2000ml。
再加
| MgCl2.6H2O |
1.68 g |
| CaCl2 |
0.28 g |
在 121℃ 20 分鐘高壓滅菌,使用時 5 倍稀釋。 |
|
| 11.4. |
2.綿羊血球: |
| |
吸引 50ml 之 Alsever 液於注射筒,從綿羊頸靜脈無菌採取同量之血液混合後,再加 50ml 之 Alsever 液再混合後,分裝小瓶並置冰室保存,血球需要使用 4 日以上 保存者。
洗滌血球時加 2-3 倍量之生理鹽水,以 2,000rpm 遠心 15 分鐘洗滌,其沉澱物加液以吸管混合後,遠心洗滌 3 次,血球浮游液不以吸光度計量而以 1% 製備時,最後之遠心需固定為一定條件,( 如 2,500rpm 10 分 ),又血球液多少有凝血之可能性時,務必先以脫脂棉或紗布過濾。
最後之遠心終了時,充分抽去上清液,並以預先用稀釋液濕潤內腔之吸管計量 Packed Cell,然後用濾紙擦去附著在吸管外側多餘之血球。
以所要量加入 GVB 液製備血球浮游液 ( 如 2、2.5、3%),此時所使用計量之吸管混合稀釋液,使吸管內側之血球完全消失為止。 |
| 11.4. |
3. 溶血素 (Hemolysine) |
| |
溶血素乃以綿羊血球洗滌後,接種於 2kg 以上之家兔耳靜脈內,因有個體之差異,故一般使由 2-3 隻家兔,免疫血球液之注射量或免疫之方法並無一定準繩,舉例如下: |
| |
例:
| 血球液之濃度 |
注射間隔 |
注射量(ml) |
| 第 1 次 |
第 2 次 |
第 3 次 |
第 4 次 |
第 5 次 |
第 6 次 |
| (1) |
33 % |
5 日
|
1.0 |
1.5 |
2.0 |
3.0 |
4.0 |
|
| (2) |
10 % |
4 日 |
5 |
5 |
5 |
5 |
5 |
|
| (3) |
10 % |
3 - 4 日 |
2 |
4 |
5 |
5 |
|
|
| |
20 % |
3 - 4 日 |
2 |
4 |
5 |
5 |
5 |
5 |
| (4) |
10 % |
4 - 5 日 |
5 |
5 |
5 |
5 |
5 |
5 |
| |
20 % |
4 - 5 日 |
5 |
5 |
5 |
5 |
5 |
5 |
| |
50 % |
4 - 5 日 |
5 |
5 |
5 |
5 |
5 |
5 |
註:均以最後注射第 7 日試驗採血測定力價 |
| |
溶血素力價通常有 5000 倍時即刻全部採血,放置如龜甲形角瓶 ( 平底 ) 或燒皿收入 37℃ 恆溫箱使其充分凝固後,收置冰室 1 晚,即能得析出多量且不溶血之透明血清。 |
| |
溶血素血清之保存法 - |
| |
以 56℃,30 分鐘非動化後之血清加等量之甘油 ( 化學特級 ) 混合後,分裝試管或安培密封後保存於冰室,能保持力價數年之久。 |
| 11.4. |
4.補體: |
| |
補體採自天竺鼠之血清,健全之衛生管理所飼養之健康天竺鼠,在採血之當日不餵早餐飼料,心臟採血,如體重 400-700g 可每隔 4 週 1 次採血 10-12ml,乾熱滅菌化學清淨之 10 或 20㎝ 注射器,為準胸骨之左方心跳最強韌之部份以平行心臟之軸穿刺,即不會致死動物,使用過之注射器及針除非以化學清淨過不能用於其他動物,採血後把針拿掉,將注射器中之血液,壓出予 1-2 支之小試管,不要起泡,並儘量避免與空氣接觸,在室溫 60-90 分鐘,俟其凝固後以低溫遠心,上清再各別採取於小試管遠心,完全除其血球成份後,把不溶血之天竺鼠血清混合,在以 15,000rpm 遠心 30 分鐘除去裏面之血球基質,最好 1 次備 50-100ml 之補體血清。
如由綿羊血球吸收時,天竺鼠血清 20ml 充分冷卻保持 0℃ 與在冰水中洗滌3次,與以上之遠心血球沉渣 1.0ml 充分混合 ( 不可起泡 ),1 分後 3,000rpm 7 分鐘遠心,取上清再加新的沉澱綿羊血球 1ml,在 0℃ 混合 3 分鐘,上清再加 1ml 之血球在 0℃ 10 分鐘吸收遠心,最後 15,000rpm 遠心 30 分鐘,分裝在小試管如保存於 -75℃ 在 3-4 個月間力價不變。 |
| 11.4. |
5.實施方法 |
| |
表 1 溶血素使用量測定法 ( Titration of Hemolysin)
溶血素稀釋法
溶血素血清
(x100) |
稀 釋 法
|
稀 釋 倍 數 |
| 0.2 |
0.8 |
x 500 |
| 0.2 |
1.8 |
x1,000 |
| 0.2 |
2.8 |
x1,500 |
| 0.2 |
3.8 |
x2,000 |
| 0.2 |
4.8 |
x2,500 |
| 0.2 |
5.8 |
x3,000 |
| 0.2 |
6.8 |
x3,500 |
| 0.2 |
7.8 |
x4,000 |
| 0.2 |
8.8 |
x4,500 |
| 0.2 |
9.8 |
x5,000 |
表 2 溶血素血清之力價檢定
| |
|
|
|
|
|
|
|
|
|
|
c1 |
c2 |
c3 |
| 稀釋倍數 |
500 |
1,000 |
1,500 |
2,000 |
2,500 |
3,000 |
3,500 |
4,000 |
4,500 |
5,000 |
500 |
|
|
| 溶 血 素 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
- |
- |
| 血 球 液 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
0.25 |
| (2 - 3 %) |
混合後 放置室溫10分鐘 |
| 補 體 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
- |
0.5 |
- |
| (1:30) |
|
|
|
|
|
|
|
|
|
|
|
|
|
| 稀 釋 液 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
0.5 |
1.0 |
0.75 |
1.25 |
| 判定 (例) |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
2 |
4 |
4 |
4 |
註1 CI ( 對照 1) 溶血素之溶血性 ( 無補體),C2 補體之溶血性 (無溶血素),C3 鹽水對照
|
| |
由表 2 之判定所示完全溶血之最高稀釋倍數為 4,000 倍 ( 1單位),使用時普通為 2 單位 ( 即使用 2,000 倍稀釋 ) 或以上。
表 3 補體單位之測定
| 試管No. |
補體
1:30 |
抗 原
(或食鹽水) |
食 鹽 水
(稀釋液) |
※
感作血球液 |
|
使用稀釋倍數
2單位/ml |
|
|
| 0.09 |
ml |
| 0.10 |
ml |
| 0.11 |
ml |
| 0.12 |
ml |
| 0.13 |
ml |
| 0.14 |
ml |
| 0.16 |
ml |
| 0.18 |
ml |
| 0.20 |
ml |
| 0.22 |
ml |
| |
0 |
|
| 0.25 |
ml |
| 0.25 |
ml |
| 0.25 |
ml |
| 0.25 |
ml |
| 0.25 |
ml |
| 0.25 |
ml |
| 0.25 |
ml |
| 0.25 |
ml |
| 0.25 |
ml |
| 0.25 |
ml |
|
0
|
|
|
| 0.66 |
| 0.65 |
| 0.64 |
| 0.63 |
| 0.62 |
| 0.61 |
| 0.59 |
| 0.57 |
| 0.55 |
| 0.53 |
| 1.0 |
|
| 0.5 |
ml |
| 0.5 |
ml |
| 0.5 |
ml |
| 0.5 |
ml |
| 0.5 |
ml |
| 0.5 |
ml |
| 0.5 |
ml |
| 0.5 |
ml |
| 0.5 |
ml |
| 0.5 |
ml |
|
38℃
水
溶
槽
中
30
分
鐘
|
|
※感受血球液之製備:2 或 3 單位之溶血素與血球液同量迅速混合 |
| |
| (1) |
完全溶血所示之補體最少量為正單位 ( exact unit),普通多使用 2 正單位 |
| (2) |
本試驗,抗原單位測定時 0.5ml 之補體中應含有 2 正單位,例如1:30 稀釋之 0.16ml 為 1 正單位時,使用量應為 0.32ml ( 2 正單位 ) 故
50
30×--=47,即 1:47 稀釋之 0.5ml
32
本試驗
Box-titration 之一例
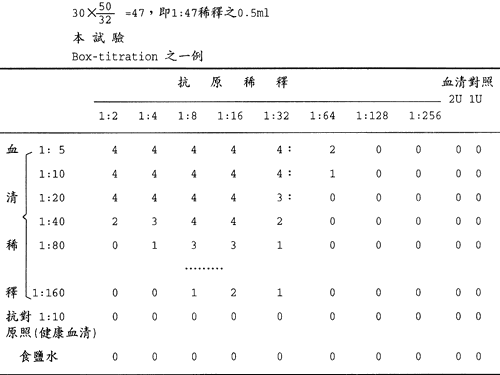
由表判讀 3+ 為陽性終末價 ( 但有時依序取 4+ 或 2+ 者 )
4+:完全阻止溶血
3+:75﹪阻止溶血
2+:50﹪阻止溶血
1+:25﹪阻止溶血
如得上表之成績,因抗血清在 1:80 呈陽性,其 1:20 之抗原陽性終末價為 1:32,因此本抗原乃 32 單位 ( 0.25ml),抗原因 1:32 尚為陽性,其 1:16 之血清陽性終末價乃 1:80,因此抗血清係 80 單位 ( 0.25ml)。
抗原與血清單位之測定,大體依照如上述基準來決定。最主要者莫過於以血清確實呈陽性價之範圍內來決定抗原單位,而抗原確呈陽性價之範圍內來決定血清之使用單位,有時仍以反應系統或所呈現之成績酌情形研判。 |
|
| |
|
| 11.5. |
中和 END 法的測定 |
| |
楊揚輝、黃天祥
|
| |
有關細胞、病毒之同定與準備事項請參閱第九章豬瘟中和抗體試驗 (END Method) 步驟如下: |
| 11.5. |
1. 中和試驗係以 96 孔微量塑膠培養盤進行試驗,以 0.025ml 細胞生長液作為稀釋並加等量的血清進行 2 倍連續稀釋。 |
| 11.5. |
2. 稀釋後之血清再加入等量的 A76 豬瘟病毒液 (100 TCID50),培養盤在震盪器上充份震盪後放置於 37℃ 5% CO2 孵卵器內感作 1 小時。 |
| 11.5. |
3. 感作後每孔再加入 0.1ml 之初代豬睪丸細胞液 (4 × 10^5 個細胞 ),然後放置在 37℃ 5% CO2 孵卵器內培養 4 天。 |
| 11.5. |
4. 經吸去培養液後,每孔加入 0.1ml 的宮寺株新城雞瘟病毒液 ( 1 HA 單位 ) 攻擊。再放置 37℃ 5% CO2 孵卵器內培養。 |
| 11.5. |
5. 試驗中同時設立豬瘟陽性和陰性血清、豬瘟病毒、豬瘟與新城雞瘟病毒、新城雞瘟病毒以及正常細胞等對照組。標準陽性血清與預測血清的處理方法同。 |
| 11.5. |
6. 每天觀察細胞情形並以第 3 天為最終判讀。 |
| 11.5. |
7. 判讀時,若量太多而不便使用顯微鏡觀察,則可用 0.5% 結晶紫甲醇溶液固定染色十分鐘,以自來水沖洗乾淨後觀察之。 |
| |
| 註: |
0.5% 結晶紫甲醇溶液配法如下:
結晶紫 (Crystal Violet) 0.5 克 |
| |
70% 甲醇 (Methanol) 100 ml |
| |
完全溶解後即可使用。 |
|
| |
|
| |
參考文獻: |
| |
| 1. |
Komaniwa, H., Fukusho, A. and Shimizu, Y. 1981. Micromethod for performing titration and neutralization test of hog cholera virus using established prcine kidney strain. Natl. Anim. Hlth. Quart., 21, 153-158
|
| 2. |
Kumagai, T., T. Shimizu, S. Ikeda, and M. Matumoto. 1961. A new in vitro method (END) for detection and measurement of hog cholera virus and its antibody by means of effect of HC virus on Newcastle disease virus in swine tissue culture. I. Establishment of standard procedure. J. Immunol. 87, 245-256. |
| 3. |
Matumoto, M., T. Kumagai., T. Shimizu, ands S. Ikeda. 1961. A new in vitro method (END) for detection and measurement of hog cholera virus and its antibody by means of effect of HC virus on Newcastle disease virus in swine tissue culture. II. Some characteristics of END Method. J. Immunol. 87, 257-268. |
| 4. |
Shimizu, T. et al. 1964. A new in vitro method (END) for detection and measurement of hog cholera virus and its antibody by mean of effect of HC virus on Newcastle disease virus in swine tissue culture. III. END neutralization test. Arch. Ges. Virusforsch. 14:215-226. |
| 5. |
S.S. Lai; W.C. Ho; T.S. Huang; S.K. Wan and T.C. Lin. 1978. A simple and rapid microtiter procedure for END Method to determine Hog Cholera andibody titers. J. Chinese Socd. Vet. Sci. No. 2:109-111. |
|
| |
|
| 11.6 |
間接免疫酵素斑點染色法 |
| |
( Indirect Immunoperoxidase Plaque Staining;IIPS) |
| |
楊揚輝、黃天祥
|
| 11.6. |
1. PK-15 和 RK-13 株化細胞先以滅菌之 PBS 洗 3 次除去血清蛋白後以 0.25% 胰蛋白酵素 (TVS) 混合 EDTA (0.02%) 在 37℃,10 分鐘,從角瓶消化下來,馬上以含 10% 牛血清之 MEM 培養液與細胞液混合而使其停止消化,並以 800rpm,10 分鐘遠心分離,並以含 10% 胎牛血清及抗生素之 MEM 作成細胞懸浮液。(原細胞培養瓶面積:欲培養之面積=1:3)。 |
| 11.6. |
2. PK-15 和 RK13 細胞懸浮液分裝於 24 孔組織培養盤,每孔 1ml,並置於 37℃,5% CO2 恆溫器內培養 2-3 天。 |
| 11.6. |
3. 等細胞長滿後,將細胞生長液甩棄,並於 PK-15 培養盤接種豬瘟病毒 0.4ml ,此病毒內含培養 3 天後能使每孔細胞形成 100 Plaques 的病毒量;而 RK-13 細胞接種豬假性狂犬病病毒,每孔接種病毒液 0.4ml ( 內含培養 2 天後能使每孔細胞形成 100 Plaques 的病毒量 )。 |
| 11.6. |
4. 於 37℃,5% CO2 恆溫器內感作 1 小時,不必搖動。 |
| 11.6. |
5. 甩去病毒接種液,並於每孔加入 1ml 的 0.7% Agarose-MEN*,並待凝固。
* 0.7% Agarose-MEN 配法:
| 2X MEM ( 含 NaHCO3) |
80 ml |
| 胎牛血清 |
20 ml |
| Fungizone |
500μg |
| Gentamycin |
10 mg |
混合均勻後置水浴槽內加溫至 45℃ 時再加入 100ml 等溫之 1.4% Agarose**,充份混合後備用。
** 1.4% Agarose 配法:
以 20lbs,121℃ 高壓高溫溶解滅菌 30 分鐘後,置於 45℃ 水浴槽內降溫。 |
| 11.6. |
6. 倒置放於 37℃,5% CO2 恆溫器內培養,豬瘟病毒 3 天,豬假性狂犬病病毒 2 天。 |
| 11.6. |
7. 將細胞培養盤置入 4℃ 冰箱 30 分鐘。取出,以藥匙末端或外科刀片挖出 Agarose,並馬上將培養盤細胞層以吹風機吹乾。 |
| 11.6. |
8. 每孔加入 1.0ml 之 PLP 固定液 *10﹪中性福馬林 @,室溫固定 10-30 分鐘。
|
| |
*PLP 固定液配法:
| m-SodiumPeriodate (0.21386g/100ml) |
0.01M |
| Lysine Buffer (pH=7.4)** |
0.1M |
| Paraformaldehyde |
1.0﹪ |
**Lysine Buffer 配法:
| 0.2 MLysine Monohydrochloride (3.654g/100ml) |
100.0ml |
| 0.1dMNa2HPO4 (1.4196g/100ml) |
100.0ml |
以磁力攪拌器混合後以 HCl 調整 pH 至 7.4;每週新配或使用前過濾。 @10﹪中性福馬林液為美國 Fisher 公司製品。 |
| 11.6. |
9. 固定後以PBS * 快洗 2 次,浸洗 1 次 ( 浸泡 10 分鐘後甩棄 PBS)。若不立即染色應以蒸餾水洗淨、乾燥,並以封條密封,置 -70℃ 冰櫃保存。
*PBS 配法:
| NaCl |
80.0 g |
| KCl |
2.0 g |
| Na2HPO4 |
11.5 g |
| KH2PO4 |
2.0 g |
| 溶入 10 公升 DDW 中,並調整 pH 值至 7.3,滅菌後使用。 |
|
| 11.6. |
10. 被檢豬血清經 PBS 適當稀釋後 (1:10 及 1:100),各別加入病毒感染細胞盤內,每孔 0.4ml。 |
| 11.6. |
11. 於室溫中感作 30 分鐘,以 PBS 沖洗 2 次,最後 1 次以 PBS 浸泡 10 分鐘,甩棄 PBS。 |
| 11.6. |
12. 於每孔加入 0.4ml 預先測定且已適當稀釋之山羊抗豬 IgG 過氧酵素標示抗體 (Caprine Anti-Swine IgG-Horseradish Peroxidase Conjugate)。 |
| 11.6. |
13. 於室溫內感作 30 分鐘,以 PBS 洗 3 次,最後 1 次以 PBS 浸泡 10 分鐘,甩棄 PBS。 |
| 11.6. |
14. 於每孔加入 0.4ml 受質,直至斑點呈色後,甩棄受質,以自來水洗去,晾乾後觀察 |
| 11.6. |
14.1. 受質: |
| |
將 10mg 之 3.3'-Diaminobenzidin 溶於 10mlPBS 含有 0.01﹪H2O2。本受質呈色後,斑點為咖啡色。 |
| 11.6. |
14.2. A.B.C. 受質 (ABC substrate)。本受質之染色斑點呈粉紅色。 |
| |
| (A) |
Acetate Buffer (0.1M pH=5.2)
取 21ml 0.1N 醋酸液 * 加 79ml 0.1M 醋酸鈉液 **,並互調 pH 至 pH = 5.2。使用時應配新,舊液超過 1 禮拜者恐不能使用。
*0.1mlN 醋酸液
6.0ml 冰醋酸加蒸餾水至 1000ml,使成 0.1N 醋酸液,保存於室溫。
**0.1M 醋酸鈉液
13.6g 醋酸鈉 (Sodium Acetate.3H2O) 加蒸餾水至 1000ml,使成 0.1M 醋酸鈉液,保存於室溫。 |
| (B) |
A.E.C. Stock Solution:
30mg 之3-Amino-9-Ethylcarbamizol 溶於 7.5ml 之 N。
N-Dimethyl-formanide,放於 10ml 有色瓶內,置於 -20℃ 保存備用。 |
| (C) |
A.B.C. 受質配法:
4.5 ml Acetate Buffer, pH = 5.2
0.3 ml AEC Stock Solution
0.06 ml 0.3﹪H2O2
混合均勻後過濾供用。 |
|
| |
|
| |
參考文獻 |
| |
| 1. |
何維莊、黃天祥、費昌勇、邱仕炎、潘英章 1988. 應用酵素標幟抗體病毒灶染色法測定豬瘟病毒及抗體. 中華民國獸醫學會雜誌. 14:81-87. |
| 2. |
費昌勇、黃天祥、馬屏禾、1988. 酵素標幟抗體之開發及接合技術之改進及研究. 台灣省畜衛試所研報. No. f24:105-110. |
| 3. |
Alan Johnstobe/Robin Thorpe. 1987. Immunochemistry In Practice. Second Edition. P261-289. |
| 4. |
I.C. Pan:T.S. Huang and W.R. Hese. 1982. New method of antibody detection by indirect immunoperoxidase plaque staining for serodiagnosis of African Swine Fever. J. of Clinical Microbiology. Vo1. 16. No. 4, 650-655. |
|
| |
|
| 11.7. |
單株抗體之製造 |
| |
吳義興
|
| 11.7. |
1. 概說 |
| |
當兩個細胞緊密接觸時,其細胞膜會融合在一起,形成一個含兩個不同核之細胞,稱為異核細胞 ( Heterokaryon),在此過程中若兩個核融合在一起,產生一個含原先兩個核遺傳基因之單核細胞,此種細胞稱為融合細胞或融合瘤 ( Hybrid)。由分泌抗體之 B 淋巴球與骨髓瘤細胞融合成之細胞,若經單株化處理使僅存單一細胞,此單一融合細胞增殖之後裔可產生一群均勻抗體分子,稱為單株融合瘤抗體 ( monoclonal hybridoma antibody),簡稱為單株抗體。單株抗體由於有極高之特異性,可應用於各種細胞、微生物或抗原之分離、純化及鑑別,故迄今單株抗體之製造已成為生物科技研究不可或缺之一種技術。
單株抗體之製造技術於 1975 年首先由 Kohler & Milstein 報告,以產生抗體之小白鼠脾細胞和小白鼠骨髓瘤細胞融合成一種融合細胞,它可如脾淋巴細胞一樣產生抗體且可如骨髓瘤細胞一樣之快速增殖。此報告引起極大之震撼,激起世界各研究機構加入研究,其後有多量之報告發表,迄今細胞融合之技術已廣泛應用於各種生物科技之研究,融合細胞單株抗體之製造方法雖有些小部份之爭論,但大部份均已統一定型,本文仍為初學或操作者提供基本之樣板過程,至於實際操作還需依各種不同之微生物或目的略作小量之修正。 |
| 11.7. |
2. 材料與培養液 |
| |
| 1. |
細胞培養液:培養液使用 PRMI1640 添加 10﹪胎牛血清,2mM Glutamine,100 IU/ml Penicillin,100μg/ml Streptomycin。Glutamine 在液體中之半衰期為 2 週,故雖所用之培養基中已有添加,若泡製之培養液保存超過 2 週乃應再予添加。其他培養液如 Dulbebccos' MEM,Iscoves' medium 等亦可使用,但重要的是要注意,大多細胞改變培養液常會使細胞發育變差或甚至死亡。 |
| 2. |
HAT 選擇培養基:上述之培養液添加 hypoxanthine (136μg/ml),aminopterin (0.19μg/ml),thymidine (3.88μg/ml)。通常泡成 100 倍之濃 HAT 液凍結保存,使用時依每 100ml 培養液加 1ml 而使用。 |
| 3. |
HT 選擇培養基:上述之選擇培養液但不添加 aminopterin。 |
| 4. |
磷酸緩衝液 (phosphate-buffered saline,PBS):NaCl 8.0g,KCl 0.2g,Na2 HPO4 ( 無水 ) 1.15g,KH2PO4 ( 無水 ) 0.2g。先溶於 800ml 之蒸餾水,調 pH7.3 後再加蒸餾水到總量為 1000ml,15 磅 / 平方吋 15 分鐘蒸氣滅菌。 |
| 5. |
蓋氏溶血培養基 ( Gey's hemolytic medium)
| 蓋氏 A 液: |
NH4Cl |
53.0 g
|
| |
KCl |
1.85 g
|
| |
K2HPO4 |
0.119 g
|
| |
Glucose |
5.0 g
|
| |
Phenol red |
0.05 g
|
| |
Gelatine ( Difco) |
25.0 g
|
| |
D.W. |
1000 ml
|
各成份溶解混合後分裝各 20ml 後,15 磅/平方吋 15 分鐘蒸發滅菌。
| 蓋氏 B 液: |
MgCl2.6H2O |
4.20 g
|
| |
MgSO4.7H2O |
1.40 g
|
| |
CaCl2 |
3.40 g
|
| |
D.W. |
1000 ml
|
各成份溶解混合後分裝各 10ml 後,10 磅 / 平方吋 10 分鐘蒸氣滅菌。
| 蓋氏 C 液: |
NaHCO3 |
5.6 g
|
| |
D.W. |
100 ml
|
溶解後以過濾膜過濾滅菌
蓋氏溶血培養基:應於使用前 30 分鐘內泡製。
| |
D.W. |
14.5 ml
|
| |
A 液 |
4 ml
|
| |
B 液 |
1 ml
|
| |
C 液 |
0.1-0.5
|
依其新鮮度,使 pH 7.2-7.4。 |
| 6. |
PEG/DMSO 融合劑:PEG 10g 放於密封玻璃三角瓶,15磅 / 平方吋 15 分鐘蒸氣滅菌。在其尚熱時加入含 15﹪DMSO PBS 液 14ml,混合後保存冰箱中。 |
| 7. |
抗生素及抗黴菌:除 penicillin 及 streptomycin 外,培養基中亦可添加其他抗生素如:gentamycin 0.2mg/ml,tylosin 25μg/ml,neomycin 100μg/ml,kanamycin 500mg/ml,novobiocin 200μg/ml 等亦可選用。抗黴劑可添加 fungizone(amphotericin B) 5-10μg/ml,或 mycostatin 100μg/ml。 |
|
| 11.7. |
3. 抗原及免疫設計 |
| |
| 1. |
免疫動物: 用於融合之細胞,遺傳基因愈相近,融合成功之機率愈高。由於融合細胞所使用之骨髓瘤細胞大多來自 BALB/C 小白鼠,若使用其他品種小白鼠,雖融合成功率亦很高,但在融合後接種小白鼠以生產含單株抗體之腹水時,則會因融合細胞含有不同H2抗原而產量不理想。 |
| 2. |
抗原之種類有細胞膜抗原、小份子可溶性蛋白質、脂質或多醣類抗原等。不同之抗原其最佳免疫程序不相同。理論上融合瘤因需一再之單株化而不需要很純之抗原,但不純之抗原使免疫後產生之抗體多元化,致使抗體特異性降低,故提高抗體特異性最簡單之方法是使用純化之抗原。 |
| 3. |
細胞融合後,融合細胞中可分泌抗體之細胞比例,依小白鼠免疫之好壞而定。可溶性抗原之免疫通常需添加佐劑如佛氏完全佐劑等,為使 B 細胞獲得更特異性之刺激,需多次免疫注射,甚至反覆的注射 5 次 ( 每週 1 次 ) 之多。細胞之膜抗原不需要添加媒劑,其免疫注射,一般免疫 2 次,間隔 2-4 週,以 IV 或 IP,每次注射約 1000 萬個細胞,第 2 次免疫後 4-5 天即可採取淋巴細胞進行融合。 |
|
| 11.7. |
4. 骨髓瘤細胞株 |
| |
所用之骨髓瘤細胞株必需符合以下準則;第一,此種細胞株需極易增植發育,與淋巴細胞融合後仍可迅速發育且分泌高濃度免疫球蛋白。第二,必需有可與融合細胞分離之特性。後者最常使用為 HGPRT ( hypoxanthine guanine phosphoribosyl transferase) 缺損性骨髓瘤細胞, aminopterin 可阻止骨髓瘤細胞核酸之正規合成經路,使其僅能以 HGPRT 酵素依旁支輔助經路利用 hypoxanthine 及 thymidine 合成核酸,若骨髓瘤細胞缺乏 HGPRT 酵素,則在含 HAT 培養基中將完全無法合成核酸而死亡,但融合細胞因自淋巴細胞取得 HGPRT 酵素之基因而得以存活增殖。
| 1. |
敏感性骨髓瘤細胞株有;小白鼠之 P3,P3/653,NS1,SP2,及 FO,鼠之 RCY3 等。但 P3 株會產生其本身之免疫球蛋白,融合後大部細胞只產生本身之免疫球蛋白,僅約 1/16 之分泌性融合細胞產生淋巴球之免疫蛋白。 NS1 及 RCY3 雖不會分泌本身之免疫球蛋白,但會合成輕鏈,使 3/4 之融合細胞分泌之免疫球蛋白摻雜此種輕鏈。因此目前最常使用者為 P3/653,SP2 及 FO 等株。 |
| 2. |
骨髓瘤細胞株之保存:骨髓瘤細胞經繼代培養後有時會失去融合能力,其可能原因為黴漿菌污染、過度增殖或高濃度、變異為融合後不俱分泌性及其他原因。因此骨髓瘤細胞最好培養到 3-5 × 105/ml 後分裝安瓶,保存於液態氮中。另骨髓瘤細胞有時亦會轉變成抗 aminopterin 株,若其比例太高亦會造成融合後選株之困擾,因此需定期繼代培養於含 8-azaquanine (20μg/ml 或 6-thioguanine (40μg/ml) 之培養液中。 |
| 3. |
融合前之骨髓瘤細胞:僅可能使大部份骨髓瘤細胞於 G2+M 生長期下,可在使用前 24 小時取 2-5 × 105/ml 細胞加 50﹪新鮮培養液培養。 |
|
| 11.7. |
5. 骨髓瘤與淋巴細胞之融合 |
| |
| (1) |
融合前之準備:
| 1. |
免疫之小白鼠在融合前 4 天再次補強免疫。 |
| 2. |
融合前 1 天繼代骨髓瘤細胞,使其增殖到約 2-3 × 105/ml。 |
| 3. |
含抗生素及 10﹪胎牛血清之 RPMI1640 培養基。 |
| 4. |
蓋氏培養液。PEG/DMSO 融合劑取出加溫到 37℃ 備用。 |
| 5. |
HAT 選擇培養基:100 倍原液 1ml 加 99ml 上述之 RPMI 培養液。 |
|
| (2) |
融合步驟:
| 1. |
小白鼠以 CO2 ( 乾冰) 窒息後,腹部以 70﹪酒精消毒後,無菌操作剖取出脾臟,放於含 20ml 培養基之培養皿。 |
| 2. |
以注射針及筒把培養液注入脾臟內,再以夾子及針頭把脾撕碎分散。 |
| 3. |
脾細胞移入尖底管,放置約 5 分鐘,取上部單細胞液移入另支尖底管,離心 200g 5 分鐘。 |
| 4. |
使用前 30 分鐘內泡製蓋氏液;14.5ml 蒸餾水,4ml A 液,1ml B 液及 0.1ml C 液,使 pH 為 7.2-7.4。 |
| 5. |
脾細胞再懸於蓋氏液,經 5 分鐘離心 200g 5 分鐘,以培養液洗 1 次後懸於 10ml 之培養液中,以 trypan blue 液計算活細胞率,必需 85﹪以上才可使用。 |
| 6. |
骨髓瘤細胞 200g 5 分鐘離心後再懸於於培養液中,以 trypan blue 液計算活細胞率,必需 90﹪以上才可使用。骨髓瘤細胞以培養液稀釋到脾細胞濃度之 1/10。 |
| 7. |
等量之脾細胞液與骨髓瘤細胞液 ( 各 10ml) 混合,200g 5 分鐘離心後儘可能去上液。滴加PEG 液 1ml 並以吸管輕輕吸取混合,共約 1 分鐘。 |
| 8. |
在融合液輕輕搖動混合中,以 10 分鐘以上之時間,緩緩滴入 3ml 已加溫到 37℃ 之培養液。於搖動混合中再以 10 分鐘滴加 10ml 培養液。 |
| 9. |
離心 200g 5 分鐘後,細胞重懸於 20ml 培養液中,倒入培養皿,放進 CO2 恆溫箱中 1-3 小時,細胞液再移到離心管。注意反覆吹吸輕洗,儘量減少細胞遺漏。 |
| 10. |
離心 200g 5 分鐘後,細胞重懸於 HAT 培養液中,其量依原先之細胞數計算調整濃度為 2×105/ml。 |
| 11. |
分裝入 24 孔之培養盤中每孔 1ml,培養孔均已預放有餵飼細胞,放入 37℃ CO2 恆溫箱中。 |
|
| (3) |
注意事項
| 1. |
採取脾細胞應儘可能輕巧,以保存細胞之活性及功能。 |
| 2. |
脾細胞亦可不除去紅血球,但如此會使脾細胞與骨髓瘤細胞接觸融合之機率降低。溶去紅血球時,使用蓋氏液可保護白血球。 |
| 3. |
骨髓瘤細胞應使用不會分泌或產生免疫球蛋白之細胞株,如 P3/653、SP2 及 FO 等,使融合細胞之分泌基因均為脾細胞者。P3/653 為 P3 為變異株。 |
| 4. |
在沖洗過程中使用之培養基通常加胎牛血清 (FCS),它對細胞之融合無礙並可使融合前之細胞維持最佳狀態,在融合中使液體保持穩定之緩衝狀態。若不加 FCS 則需添加 HEPES 緩衝液,但 HEPES 液對細胞略有毒性。 |
| 5. |
融合劑 PEG 之作用機轉仍使接觸之細胞凝集,並使細胞皺縮,細胞膜之接觸面擴大緊密貼合而融合。至於 DMSO 並非必要,但亦無害。 |
| 6. |
融合之時間必需精確,因在此時間下,可使融合最充份而細胞損傷最低。 |
| 7. |
稀釋過程必需精確,加培養液太快會使融合之細胞再次分開。稀釋後放 CO2 恆溫箱中 1-3 小時,除可使融合繼續進行外,亦可使 DMSO 漏出細胞外。 |
| 8. |
餵飼細胞之添加與否有很大之爭論,因餵飼細胞並非細胞融合所必需,但有些報告認為添加餵飼細胞可增加融合細胞量。此可能是在影響融合細胞發育之很多因子中,若有某一種不當時,餵飼細胞可給予相當程度之補救。餵飼細胞可用未免疫之脾細胞、胸腺細胞、腹腔巨噬細胞、或放射腺處理之人類纖維細胞等。 |
|
|
| 11.7. |
6. 融合細胞之增殖 |
| |
把融合細胞放入培養液中可使融合細胞增殖,阻止未融合細胞發育及支持融合瘤胞落。融合後之細胞核含 2 倍正常細胞之染色體數,此種核不穩定,在經數次之培養後,常會有染色體之流失,若流失之染色體為分泌免疫球蛋白者,則細胞變成僅會增殖但不會分泌。若流失之者為增殖之染色體,則細胞會因不發育而被淘汰。染色體之流失會逐漸停止,穩定於某一染色體數,但此種隱定過程是漸進性的,因此融合細胞經數個月之培養後,不分泌細胞可能會逐漸增加,常使其逐漸失去分泌抗體之能力。
增殖之過程如下:
| 1. |
融合後培養之細胞必需每天檢查其發育及條件 ( 顏色,酸鹼度等 )。 |
| 2. |
融合後第 7 天,每孔 2ml 培養液中 ( 其中 1ml 為餵飼細胞 ),輕輕由其上吸掉 1ml,再添加 1ml HT 培養液。再經 7 天檢查培養液之顏色,若有發育則色變黃,輕輕吸掉 1ml 舊液,添加 1ml HT 培養液再繼續培養。 |
| 3. |
取樣篩檢。太早篩檢易漏失陽性細胞,因其分泌出的抗體濃度尚低,但若太遲篩檢,融合細胞會因過度發育擁擠而死亡。因此最好在細胞未長滿前篩檢一次,其陰性者在培養液變黃時再篩檢一次。 |
| 4. |
挑選陽性細胞群落。融合細胞培養液篩檢出含有抗體時,即以吸管小心取出細胞群落,移轉到另一含新鮮 HT 培養液之培養孔繼續增殖培養,若一孔中有二個以上之胞落時,應輕輕選取各單一胞落分別移轉培養。若移轉後細胞停止發育,則應添加餵飼細胞,但應注意勿使細胞發育過密而致死亡。 |
| 5. |
在使用 HAT 培養基篩選掉無融合之骨髓瘤細胞後,需先以 HT 培養基維持融合細胞之發育,直到其增殖相當程度再改用一般培養基。突然改用一般培養基常使融合細胞死亡。 |
|
| 11.7. |
7. 融合細胞之篩檢 |
| |
篩檢之目的在及早鑑定陽性分泌細胞以便及早單株化,並及早發現無用之細胞,以免浪費時間及材料。原則上可測抗體之任何方法均可用於篩檢,但由於單株抗體之一的特性,有些二次反應之試驗不適用,如免疫沉降試驗。至於要選擇何種篩選方法依如下述之原則。
| 1. |
篩選方法必需迅速而且方便。 |
| 2. |
篩選方法若為二次反應則應注意第 2 次反應之效果,如補體結合試驗,其第 2 次反應之補結合僅 IgM,IgG2a,IgG2b 等部份免疫球蛋白,故不適用。間接螢光抗體法或放射線標示法,其第 2 次蛋白必需選用抗小白鼠全部各類免疫球蛋白者,抗部份或蛋白 A 標示者 ( 僅與部份 IgG 結合 ) 亦不適用。 |
| 3. |
單個或多重抗原決定位 (epitopes)。抗原若為單個抗原決定位,其抗原與抗體之結合物份子很小,無法形成格網狀之沉澱。若抗原有相同多重之抗原決定位,則較可能形成格網狀而沉澱。一般之抗血清所含之抗體為多種之混合,故可與一個抗原之許多不同抗原決定性結合,因此若抗體濃度達到某一程度時即可產生沉澱,但單株抗體不同,它僅含一種甚至僅對一個抗原決定位,因此即使高濃度下,亦不易形成沉澱。 |
| 4. |
前驅現象 (Prozone phenomenon);在高抗體濃度時,凝集反應反而無法形成凝集塊,此種現象稱為前驅現象。凝集試驗、沉降試驗及補體胞毒試驗等均會產生前驅現象,二次抗體結合之試驗如 IFA、放射線標示法等則不會發生。 |
| 5. |
應篩選即定要用之抗體。 |
| 6. |
由於放射線之使用有很多限制,故目前篩檢方法大部使用 ELISA 法及間接螢光抗體法 ( IFA) 為主。 |
|
| 11.7. |
8.融合細胞之單株化 |
| |
單株化之方法有多種,但以極限稀釋法 (Limiting dilution) 最常被使用。其操作步驟如下:
| 1. |
融合細胞經以 HT 培養液洗後,以色素法測其活細胞數,依其數稀釋到其細胞數含量為 0.5,1.0 及 5.0/2ml。 |
| 2. |
若使用脾細胞為餵飼細胞則如前細胞融合部份所述,由脾取細胞並以蓋氏液溶去紅血球後,以 RPMI 洗 2 次再懸於 HT 培養液中,經計算細胞數後調整濃度使其含細胞數為 1 × 106/2ml。 |
| 3. |
二者等量混合後接種於 24 孔孔微盤,每孔 1ml,放 37℃ CO2 恆溫箱中培養。 |
| 4. |
經 7 天後鏡檢,若細胞群落在一個以上或形態不對稱者均棄之。其他則繼續增殖並篩檢其培養上液,陽性細胞群落收集擴大增殖。 |
|
| 11.7. |
9.融合細胞之凍結保存 |
| |
融合、篩檢及單株化成功之融合細胞若持續培養,有時會因污染、染色體漏失、過度增殖變異為不分泌、或死亡等而前功盡廢。其最安全之方法為取部份凍結保存。
| 1. |
融合細胞以培養液一次後,懸於含 50% FCS 之 HT 培養液中,並調整濃度為 6 × 106/2ml。 |
| 2. |
緩緩滴加入等量 30﹪DMSO 之無添加 RPMI 液,輕輕混合後分裝低溫凍結安瓶,每瓶 2ml。 |
| 3. |
降溫程序:由室溫到 -10℃ 以 1-2℃/分之速率調降,在 -10℃ 時略快,-10℃ 到 -25℃ 亦以 1-2℃/分,-25℃ 到 -100℃ 以 5-10℃/分,最後放入液態氮中保存,其溫度為 -190 - 150℃。 |
| 4. |
要使用時,由液氮保存取出放入 37℃ 水溶中,待完全溶解後立即取出,緩緩滴加等量之 HT 培養液 ( 約 10 分鐘 ),放室溫 15 分鐘,再以約 10 分鐘滴加 6ml 培養液,放室溫 15 分鐘後以 HT 培養液洗 2 次後再予培養。 |
|
| 11.7. |
10.單株抗體之特性 |
| |
單株抗體最重要需瞭解之特性為其特異性,其次為力價、結合之親和力、保存之隱定性、免疫球蛋白之類別及次類別、及單源性。
| 1. |
特異性.瞭解單株抗體之特異性才能評估其應用價值,以不同但相近易混淆之抗原作篩檢試驗,決定單株抗體對各種抗原之特異性。 |
| 2. |
力價.單株抗體以 2 倍系列稀釋後,測定其最終陽性反應之稀釋倍數,若為 1/64,此倍數之倒數即為其每 ml 之力價 64,再以 Lowry 或 Biuret 法測定其每 ml 含總蛋白量,若為 0.01mg/ml,則此抗體之力價為 6400 單位/mg。 |
| 3. |
結合之親和性.一般在單株抗體較少人注意此,也很少人作此測定。 |
| 4. |
保存之隱定性.單株抗體保存在 -20℃ 其活性仍會下降,應保存於 -80℃ 或液態氮中。反覆之凍融亦會使大部之蛋白質受損,應予避免。經常使用可另分裝一小瓶放+4℃ 中,添加 1/1000 氮化納防污染即可使用數週。 |
| 5. |
免疫球蛋白之類別.購買各種免疫球蛋白 Class/Subclass 之抗血清,再依明膠免疫擴散法測試,即可分其為 IgGa,IgG1,IgG2b,IgG3 或 IgM。 |
| 6. |
單源性.單株抗體應為單一型細胞所產生之單一類或單一次類免疫球蛋白。4 份細胞 ( 1-2×106/ml) 加一份核染色液 ( Ethidium bromide 200μg/ml 1 份,Mithramycin 100μg/ml 於 150mM MgCl 液 2 份,1%Triton X-100 17 份 ,三者混合後應於 30 分鐘內使用 ) 混合後,放入流動細胞計數器 (flow cytometer),經 410 - 457nm 激光後,被染色之 DNA 即會發出螢光。由儀器描出之光量圖,依甚第 1 升峰 (G1) 之形狀,可知其為單一種細胞或多種細胞之混合。若結果非為單一細胞,則應再行單株化。 |
|
| 11.7. |
11.單株抗體之生產、純化及標示 |
| |
| 1. |
單株抗體之生產.生產可用組織培養法或小白鼠接種法。組織培養法仍把融合細胞持續培養,經某一定時間收集其上液,此種方法產量較低但抗體液較純。小白鼠接種法,BALB/C 小白鼠腹腔注射 0.5ml Pristane,注射後 7 天小白鼠腹腔再接種融合細胞,其後 7-14 天抽取小白鼠產生含抗體之腹水液,經離心及非動化即可保存。 |
| 2. |
單株抗體之純化:組織培養上液或腹水液中之單株抗體純化可用 45﹪飽和硫酸銨使其沉澱出,再經過透析及離心即成。由於免疫球蛋白帶陰電,故可用帶陽電之離子交換子,如 DEAE cellulose 或 Sephadex 等,作離子交換層析而純化。另亦可使用蛋白 -A-Sepharose 作親和性分離而純化。 |
| 3. |
單株抗體之標示:為應用上之目的,單株抗體可以同位素碘 125 或螢光色素作標示,其標示方法與一般血清抗體標示之方法相同。 |
|
| 11.7. |
12.總結 |
| |
單株抗體之製備需一連串步驟之成功,它包括:小白鼠之免疫,適用於融合之骨髓瘤細胞株之取得及持續培養,小白鼠免疫細胞與骨髓瘤細胞之融合,融合細胞形成一小群細胞,融合細胞增殖並非去掉其他發育細胞。之後融合細胞增殖,篩檢理想之分泌細胞,篩選出之細胞再經數次單株化。單株化之融合細胞即可開始生產單株抗體,細胞並作部份凍結保存,以保存融合細胞之免疫球蛋白基因。產製之單株抗體測其特性,為進一步應用可作純化及標示。 |
| |
|
| 參考文獻: |
| |
| 1. |
東京大學醫科學研究所學友會。1958 年。細菌學實習提要。丸善株式會社出版。日本東京。 |
| 2. |
川村齊。1982年。雞 病血清反應。
堀內貞治編「雞病診斷」P595 ~ 606,家光協會發行。日本東京。 |
| 3. |
Harlow E. and Lane D. 1988年。Antibodies,A Laboratory Manual. Cold Spring Harbor Laboratory. New York. U.S.A. |
| 4. |
Kennett RH, Mckearn JJ, and Bechtal KB. 1980. Monclonal antibodies. Plenum Press, New York |
|

 、卅、廾、十記號。如表示十即血清之最終末稀釋倍數或其血清之凝集素力價。
、卅、廾、十記號。如表示十即血清之最終末稀釋倍數或其血清之凝集素力價。


