| 9.1. |
病毒之分離: |
| 9.1. |
1. 病毒分離用病材之收集及其操作: |
| |
病毒分離用之病材通常為血液、脊髓液、滲出液、疱囊液、生理組織、屍體組織、咽喉洗液等等。依各種疾病之特性而收集不同之病材,下表略舉: |
| |
|
| |
| 1.採取時間: |
病材之採取時機及操作,對病毒之分離成功與否有相當重要的關係。一般而言,病材應在疾病之急性期採取,若錯過時候,則病毒之被發現機會就大會減少。 |
| 2.採 取: |
病材之採取之器具及操作應極力避免污染,組織器官之間之交叉污染亦應避免,如腸內容污染到腦等。病材採取後,置於無菌容器中,標明後立即置於冰箱中;棉拭 (Swabs) 在試管內保存時,加入 1.0ml 之營養肉汁或適當之緩衝液;水 液以無菌注射筒或毛細管採取,立即以脫脂乳或組織培養液稀釋,置入冰箱中。病材在輸送過程一直到接種於適當宿主止,其間接應保持在冷的狀態下。 液以無菌注射筒或毛細管採取,立即以脫脂乳或組織培養液稀釋,置入冰箱中。病材在輸送過程一直到接種於適當宿主止,其間接應保持在冷的狀態下。 |
| 3.輸 送: |
病材注入無菌試管或瓶內,再置於金屬容器中 ( 或紙板 ),以紙或棉花充塞其空隙,防震及吸收滲入之液狀,此容器再置於夠大的纖維板或塑膠容器中,其間,放置足夠的乾冰,乾冰之間塞入細鉋花、木屑、碎紙等,以填充乾冰間之空隙,保護其內之容器。如果不克使用乾冰時,品質優良,中性,且以緩衝生理食鹽水泡成之 50% 甘油,可資應用,但在螢光抗體檢查時,則不能使用甘油。 |
| 4.儲 存: |
病材最好保持於-70℃之下,某些病毒在-20℃ ~ -25℃下保存時,其感染力在短時間內不致降低,但在-70℃之下,則可維持較長時間。如果使用乾冰時,則病材應置於火焰封口之安瓶內,以避免 CO2 影響病毒之活性,或可將病材置於螺旋蓋試管或瓶子內,再置於塑膠袋內,保存於乾冰中。 |
|
| |
|
| |
表 2 操作流程: |
| |
儘可能在病程早期採取病材;若死亡,應立刻解剖採材。
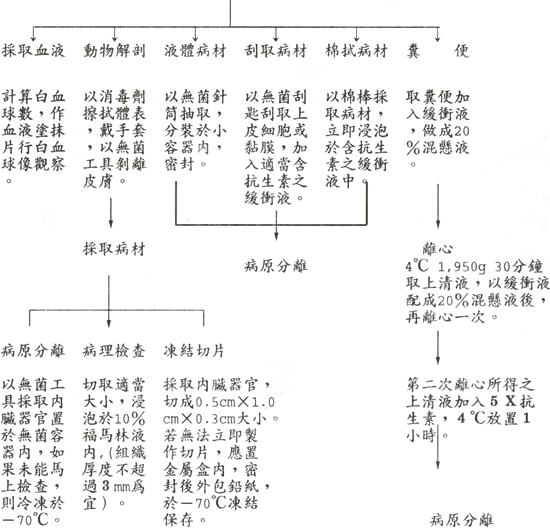 |
| |
|
| |
(二) 雞胚胎接種法 |
| |
接種用之種雞蛋必須從無病毒及細菌傳染病之雞群獲得。種蛋在 37℃,40-70﹪濕度之下,孵育 4~5 天,然後再檢查受精與否,種蛋在孵化期間必須於一定時間給予翻動,以免胎膜黏著。 |
| |
|
| |
接種技術: |
| |
| (1) 羊 膜 腔 接 種 : |
將病材直接注入羊膜腔內,經由呼吸道而增加病毒增殖之可能性,但由於可被收獲之羊水及羊膜組織量不多,因之以此法分離病毒時,常經由尿囊腔,將病材注入,使病毒亦能增殖於尿囊腔內。 |
| |
| 13~14 日齡或 10~12 日齡之雞胚胎可資利用。蛋之氣囊瑞 (即鈍端) 以碘酊拭擦,再以尖的探計在碘酊拭擦處打一孔,再以碘酊拭擦,取 23gauge,1 3/4inch 長針頭,在燈光透視下經由屎囊腔向著胎兒之陰影刺入,如圖1。 |
|
| 蛋殼上之洞口以碘酊拭之,以臘封口,視病毒之種類,將接種之雞胚胎蛋置於不同溫度之孵卵器內。 |
|
| |
收獲胚胎液前,須將蛋移入 4℃ 冰箱中 18 小時,使其血管收縮,此項操作在 Myxoviruses 時特別重要,因紅血球會吸著 Myxoviruses 之故。 |
| |
|
| (2)絨毛尿囊膜接種: |
此一接種方式常應用於能在絨毛尿囊膜上形成 Pocks 或 Plaques 之病毒之分離、增殖及滴定。如 Herpes simplex 及 fowlpox。 |
| |
| 10~12 日齡之雞胚胎,在燈光透視下,選擇血管較發達之處,作一記號,以碘酊拭之,打一洞。另外,在氣囊端拭以碘酊,打一洞,再以橡皮吸球在氣囊端洞口上吸之,以便在欲接種之絨毛尿囊膜上造成足以滴入病材之人工氣室,將 0.1-0.2ml 之病材,以 23gauge 針頭,滴入絨毛尿囊膜上,如圖2 |
|
|
| |
將兩口封之,輕搖搖動接種蛋,使滴入之病材,分佈均勻,然後平放著,置入孵卵器內,在收獲絨毛尿囊膜前,以燈光透視,檢查人工氣室是否還在原來位置,如果位置不對的話,則以吸球在氣囊端糾正之。後以碘酊拭人工氣室上之蛋殼,以剪刀沿人工氣室邊緣將蛋殼及殼膜剪掉,檢視絨毛尿囊膜之病變。 |
| |
|
| (3) 尿 囊 腔 接 種: |
此法在大量製造病毒抗原及疫菌時應用之。 |
| |
| 10~11 日齡雞胚胎蛋,以燈光透視下,選擇後近氣室邊緣,胚胎對面,無血管處,拭以碘酊,打洞,再試以碘酊,以 26 gauge/inch 長之針頭,採取與蛋平行方向插入 1/2inch,將病材注入尿囊內,如圖 3。 |
|
|
| |
|
| (4) 卵 黃 囊 接 種: |
選 5~6日齡雞胚胎蛋,因此時卵黃囊還相當大,易於接種,亦提供較大而積之內胚層細胞供病毒增殖。 |
| |
在氣囊端拭以碘酊,打洞,以23gauge,1 3/4inch長針頭,將 0.5-1.0ml 病材注入,如圖4。 |
|
| |
|
| |
(三) 細胞培養接種法: |
| |
1.病材準備: |
| |
| (1)糞便混懸液: |
| 取一 40ml 之遠心管,內置有玻璃珠子,將 2gm 之糞便置入管內,加上 15ml 之Hanks' BSS ( 或 Earle's),塞以無毒性之橡皮塞,再覆以厚紙 ( 防糞便溢出感染實驗者 ),用力振盪之,然後 2500rpm,15 分鐘遠心。 |
|
|
| |
上層液經由滅菌紗布濾過,注於可耐高速遠心管中,以 10,000rpm,1 小時 ( 在 4℃ 下 ) 遠心,取上層液 1.8ml,加入 0.2ml 抗生素 ( 內含 25,000 unit/ml 之 Penicillin,25,000μg/ml 之 streptomycin,Neomycin 及 250 unit/ml 之 Bactracin),置入 4℃ 冰箱 1 小時。 |
|
| |
| (2)鼻腔,咽喉洗液及棉拭: |
鼻腔,咽喉洗液及棉拭置於肉汁 (Broth) 中,棉拭丟棄,取 1.8ml 之病材,加入 0.2ml 抗生素 ( 內含 10,000unit/ml 之 penicillin,50,000μg/ml 之 streptomycin) 及加入 0.02ml,1,000μg/ml 之 fungizone,置於 4℃,1 小時。 |
|
| |
| (3)組織混懸液: |
內臟器官置入滅菌之培養皿 (Petri dish) 中,以滅菌剪刀,剪取所需重量,在乳缽或研碎機中磨碎,加入含 0.75% bovine albumin 之緩衝生理鹽水其他適當溶液製成 20% suspeusion,1,500rpm, 15分鐘遠心,取上層液,如入 500 unit/ml 之 penicillin 及 500 uq/ml 之 streptomycin,在 4℃ 下 1 小時。
上述各種經過處理之混懸液,各以適當量 (0.1-0.2ml) 接種於試驗管內之單層細胞上,經 1~2 小時吸著後,加入不含抗體之維持液,置入孵卵器內,觀察 CPE,Hemadsorption。 |
|
| |
|
| |
2.組織培養 incubation: |
| |
病毒分離之適當溫度為 35°~37℃,但對某些呼吸道病毒,其最適溫度則為,33°~34℃。有些病毒在氣相及液相交互循環之情況下,才能產生較高力價及比較明顯之 CPE,因此 roller drums 就可應用之。 |
| |
3.病毒在組織培養所造成之影響之確認。 |
| |
有些病材對細胞是有毒性,因之會使細胞產生變性 ( 通常在 24~48 小時間 ),若有此現象發生時,則應立即將病材稀釋及再做次一繼代。 |
| |
|
| |
(四) 實驗動物接種法 |
| |
由於組織培養對病毒分離具有其方便及優點而取代了實驗動物,但實驗動物仍可被利用以分離某些病毒。實驗動物接種方法有 intracerebral ( 腦內 ),intraperitoneal ( 腹腔內 ),intramusculas ( 肌肉內 ),intranasal ( 鼻腔內 ),intravenous ( 靜脈內 ),subcutaneous ( 皮下 ),perOS ( 口腔 ) 及 cheek pouch ( 頰囊 ) 等,有時基於人道立場,需將動物麻醉。 |
| |
接種病材為經磨碎、遠心、抗生素處理者。 |
| |
1.不需麻醉者: |
| |
| (1) |
腹腔內接種:成鼠、齧齒動物。 |
| |
取 23gauge,1inch 針頭,以 30℃ 角在腹部中線旁邊 0.5 公分處,慢慢刺入接種之。 |
| (2) |
肌肉內接種:成鼠、齧齒動物。 |
| |
取 26gauge,1/4inch 針頭,刺入 gastrocnemius muscle 內接種之。 |
| (3) |
腦內接種:哺乳後白鼠。 |
| |
取1/4inch,26gauge 針頭,在耳朵前線、眼睛後角及頭中線等距離處,垂直刺入 2㎜ 接種。 |
| (4) |
靜脈內接種:兔-取 1 inch,26gauge 針頭,刺入耳線靜脈;接種。 |
| |
鼠 (Rat) 及白鼠-先把鼠尾浸入 55℃ 水中 1 分鐘,使靜脈;膨脹,用 1 inch,26gauge 針頭刺入尾側靜脈;接種。 |
| (5) |
鼻腔內接種:哺乳及白鼠。 |
| |
把 23gauge 1/2inch 針頭之尖端切斷磨圓滑,把針頭置於鼻孔處,緩緩將病材送進鼻腔內。 |
| (6) |
口腔內接種:同 (5) 針頭,送進口腔,使接觸到後口蓋,引起吞嚥反射,把病材緩緩擠進口腔。 |
| (7) |
皮下接種:取 1 inch,23gauge 針頭,選擇好身體皮膚較疏鬆處,注入所需病材。 |
|
| |
2.需要麻醉: |
| |
選擇不含過氧化物 (Peroxide free) 之乙醚 (Ether) 為麻醉劑,將 Rat 及 Mice 等小動物置於裝有乙醚棉花之玻璃皿內,兔子則用底端開洞,置有乙醚棉花之金屬筒套其頭部,麻醉之。此時應注意麻醉深度。 |
| |
| (1) |
腦內接種-成鼠。
如 1.3. |
| (2) |
鼻腔內接種-成貂 (Ferret)
如 1.5 |
| (3) |
口腔內接種
方法如 1.6 |
| (4) |
頰囊內接種-田鼠 (Hamster) |
| |
取1/2inch,26gauge 針頭,以左手拇指及食指翻開其口腔而露出頰囊接種之。 |
|
| |
|
| 9.2. |
病毒之純化: |
| |
純化的病毒不僅為測定病毒的化學性狀所必須,在製造疫苗時亦須用純的病毒。一般說來,動物病毒之純化有其困難存在,因用來純化病毒的那些感染組織內病毒的含量常很少,因此問題在如何從那些有相似物理化學性質的大量材料裡將少量的病毒純化出來,並且在純化過程還須儘量的不損害到病毒的感染力 (Infectivity)。
如果病毒在其繁殖過程並沒有從細胞解離到細胞外的體液 ( 或培養液 );則要純化病毒的第一步驟,即須先把細胞破壞,此可用某些消化酵素或化學藥劑,或者以超音波振盪 (Ultrasonic vibration),或迅速的凍結與融解,(Freezing and thawing) 來破壞細胞。
此後可用低速離心 (1000Xg) 把病毒粒子和細胞成分分開,因病毒粒子比絕大多數的細胞碎片小,在低速離心下,病毒仍存在於上清液,這些上清液隨之可高速離心 (50,000~100,000Xg),即可把病毒全濃縮沈澱下來,此病毒沈渣以培養液懸浮後再經一次低速後高速離心,即可將大部分的雜質 ( 細胞碎片等 ) 除去,而得半純化的病毒粒子。
進一步純化有數種方法:
層次比重離心法 (Density-gradient centrifugation) |
| |
| 1. 介紹: |
高速離心仍純化病毒最常用的一種技術,因大多數宿主物質均比病毒大或者小,而易由離心將之與病毒分開,沈降速率差異大的物質,可以變速離心法 (Differential centrifugation) 來分開,而沈降速率差異小的,則以層次比重離心法 (Density-gradient centrifugation) 較佳。
層次比重離心法是一種層析的方法,利用層次比重的溶液,將不同比重的東西經離心而分開,常用來製備層次比重液的物質有庶糖 (Sucorse),甘油 (Glycerol),鹽類如氯化銫 (Cesium chloride),氯化銣 (Rubidium chloride),酒石酸鉀 (Potassium tartrate) 等。
沈降速率和物質的大小形態,比重以及離心力之大小和所用溶液之黏度比重等均有關係,如溶液的比重與要分離物質之比重相近的話,則經長時間離心分離的程度與物質之比重相關,如要分離之物質間比重相似,則其分離就與其大小與形態有關,利用這些性質來分離物質的方法就叫 rate-zonal separation,病毒通常是一種核酸蛋白,其比重常比宿主細胞之蛋白及脂肪為高,故二者之分離即利用其此比重不同,而病毒之核酸蛋白與宿主細胞之核酸蛋白的分離則是藉其大小和形態之差異。
加在層次比重溶液上要離心分離的材料,其病毒含量最好不要超過 1mg/ml。 |
|
| |
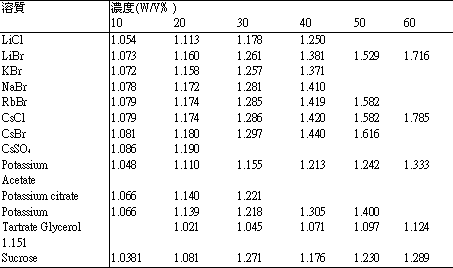
層次比重溶液: |
| |
蔗糖為最常用來配此溶液的物質,因為它可高度溶於水,而且又極少對病毒有損,常用的層次濃度是 5~20% 和 5~60%,商業上的 sucrose 常含有植物核酸酵素,(Ribonuclease),其經高速離心後,常沈澱成類似病毒的粒子,因此使用前,最好用活性炭 (Charcoal) 處理後才使用,(600~700mg/ml 之蔗糖溶液每 100ml 和 5~10gm 之活性炭,溫火煮沸,趁熱以有活性炭墊之濾器過濾後供用 )。
Glycerol ( 甘油 ),似蔗糖之濃度及離心方法可以有相似的效果,且由此分離之材料可直接供電子顯微鏡檢查用,商品之 glycerol,純度亦高,其對蛋自質之安定性亦極少有損。
酒石酸鉀 (Potassium tartrate),檸檬酸鉀 (Potassium citrate),也可做成好的層次比重液,不過其偶有將某些病毒沉澱出來的副作用,對病毒之安定性的影響,亦不甚清楚。
鹼性金屬之鹵化物亦常用來作此層析比重液,其高濃度溶液比蔗糖甘油者之黏稠度低,為其壞處,但它的好處,是有的病毒在其高濃度溶液內不安定。 |
| |
|
| |
層次比重溶液之濃度與比重。 |
| |
 |
| |
|
| |
層次比重之製備: |
| |
將不同濃度的溶液加入離心管內,形成層次比重,其添加方法有下列數種。 |
| |
| A、 |
小漏管將之伸到離心管之管底而後將較低濃度之溶液加入,而後逐次將較高濃度溶液加入,使輕者浮上來而形成層次比重。 |
| B、 |
小吸管將管之之開口向上彎曲,管口之內徑以 1~2㎜ 為宜,將高濃度之溶液先加而後逐次將較低濃度溶液慢慢滴在高濃度者上面而形成層次比重。 |
| |
A 和 B 法製成之層次比重,宜置隔夜,使其形成均勻之層次比重後使用。 |
| |
C 和 D 法之 a 係高濃度溶液,b 係低濃度溶液,m 係攪拌子,經攪拌好之溶液流入離心管形成層次比重,即可使用。E 為注射器在抽取離心好之層區時使用。 |
| |
離心材料之添加及離心:
最普通的方法是將病毒溶液以小吸管小心加在層次比重液之上面即可,離心後病毒層區 (Zone) 之大小與病毒溶液內病毒量有關,濃縮的病毒溶液可得較好的層區。
離心須在 4℃ 之高速離心機行之,時間之長短依病毒之不同而異,例如 Tobacco mosaic virus 在 1X3" 離心管 ( 由 3、7、7、7 和 4ml 之 0,10%,20%,30%,40% Sucrose 形成之層次比重液 ) 以 Spinco Model L 之 SW 25.0 rotor 在 24,000 rpm 約 5 小時即可,由離心後之層數目和層範圍的寬度 (Numbers and width of the bands) 大致可知病毒純化的程度。 |
|
| |
| 2. 化學劑法: |
此法是靠病毒特殊的化學性質來純化病毒,常用的有 fluorocarbones,此可大量的將宿主細胞的脂肪和蛋白移去,而得純化的病毒。病毒像其他蛋白質一樣,亦可用有機溶劑,如甲醇 (Methanol) 來沈澱而得濃縮之病毒。病毒亦有用硫酸銨 (Ammonium Sulfate) 來沈澱而濃縮者。 |
|
| |
| 3. 層析法 (Chromatography): |
利用離子交換物質 (Ion exchange materials,例如 Dowex 所作成之 Column,當病毒物質通過此 Column 時,用漸增鹽濃度的緩衝液,可將病毒和細胞之核蛋白分開,而得相當高純度之病毒,有很多種病毒皆可用此法作進一步之純化。 |
|
| |
4. 核酸 (Nucleasea)之反應: (Nucleasea)之反應: |
此為病毒純化之最後步驟,利用核酸 將病毒與核酸分開,如 DNA 病毒則用 RNase,RNA 病毒則用 DNase 除去污染之核酸。 將病毒與核酸分開,如 DNA 病毒則用 RNase,RNA 病毒則用 DNase 除去污染之核酸。 |
|
| |
上述的各種病毒純化步驟均曾成功的被用過,但不同病毒往往須應用不同的方法純化之,在純化過程中在每個步驟之後,最好抽檢一下病毒之感染力 (Infectivity),與所含蛋白量,愈純化的病毒,應是含愈高感染力,而較低之蛋白含量,有時亦可以電子顯微鏡來觀察其純度。 |
| |
一些構造較單純的病毒,在達足夠純化時會形成結晶,許多複雜的病毒,常在純度增加時降低了其穩定度 ( 即感染力受影響 ),此可加極少量血清蛋自,以維持適當的鹽濃度而避免之。 |
| |
|
| 9.3. |
病毒之鑑定、定量及其繼代保存: |
| 9.3. |
1. 病毒之鑑定: |
| |
一個有經驗的病毒研究者,對其新分離到的病毒大致可從其在組織培養上發育情形,引起之 CPE 形態,或者在雞胚胎發育情形及引起雞胚胎特殊病變,可以猜想分離病毒大概屬於那一類 (Group) ,而後進一步作一些初步的試驗以歸類病毒。 |
| 9.3. |
1.1. 病毒構成核酸決定: |
| |
決定病毒所含的核酸是 DNA 或 RNA,最佳的方法是先以 [14C] thymidine 及 [3H] uridine 標附之培養液培養病毒之後,用 phenol 抽出核酸,以 sugar gradient 分離核酸。如果是 DNA 病毒,則只能發現 [14C] thymidine,如果是 RNA 病毒,則只含有 [3H] uridine。
另外可利用 IUDR,FUDR 或 BUDR 等 Thymidylate 合成酵素抑制物質去判定核酸的種類: |
| |
| (1) |
把試管培育細胞分成兩組,各以 Hank's solution ( 或其他緩衝液 ) 洗滌三次。 |
| (2) |
第一組細胞培養液中如入 50μg/ml IUDR 或 50μg/ml BUDR 或 10-4M FUDR 1ml於37℃培養。 |
| (3) |
第二組細胞以不含上述物質之正常培養液培養之,當做對照組。 |
| (4) |
將未知待試的病毒以緩衝液做 10 倍稀釋列,再把各稀釋階病毒 0.1ml 接種於處理及對照組細胞內,37℃ 吸著 60-90 分鐘。 |
| (5) |
抽棄接種液,然後以緩衝溶液洗滌細胞三次。 |
| (6) |
加入 1.0ml 之正常維持液於每支試管,後再置於 37℃ 繼續培養,觀察 CPE,比較其力價。 |
|
| |
選取能在試驗細胞產生 CPE 之已知 DNA 及 RNA 病毒做為參考病毒 (Reference viruses),進行相同的試驗,以為參考。 |
| |
|
| 9.3. |
1.2. 熱穩定性試驗(Heat stabilization test): |
| |
分離之病毒 0.6ml 加上 4M 之 MgCl2 ( 或 4M 之 MgSO4 或 Na2SO4) 0.2ml 混合後置於 50℃ 定溫水槽 1~2 小時後取出,接種於有感受性之組織細胞以測定其感染力 (Infectivity) ( 接種前最好以培養液將之稀釋 10 倍,以沖淡高濃度鹽之毒性 ),此試驗對初步分離 (Grouping) 很有用處。本試驗必須包括二組對照組,其一為無加熱之病毒,另一組為病毒不加鹽類 ( 以滅菌蒸餾水代替 ) 加熱 50℃ 1~2 小時。 |
| 9.3. |
1.3. 乙醚感受性試驗 (Ether-sensitivity test) |
| |
分離之病毒懸浮於 20% 之乙醚 (Diethyl ether),用力振盪後置 4℃ 18 小時,之後以真空抽氣把乙醚抽淨,把此乙醚處理過之病毒接種於有感受性之組織細胞,以測定其感染能力,沒經乙醚處理過之病毒亦須接種當對照組。 |
| 9.3. |
1.4. 氯仿感受性試驗 (Chlorofrm-sensitivity test) |
| |
加 0.1ml 之高純度氯仿 (Analytical reagent grade chloroform) 於 1ml 之分離病毒,在室溫以手振盪 10 分鐘後,立刻將此混合物遠心 (500r.p.m. 5 分鐘 ),後有三層,最上面清晰層為病毒,中間層為混濁環,最下層為氯仿,取病毒層作 10 倍階段稀釋後接種於組織培養測定其感染力價,此試驗通常包括三組對照,一為無氯仿處理之分離病毒,其二為已知氯仿感受性之病毒如 Herpes simplex,其三為已知氯仿抵抗性之病毒如 Enterovirus。 |
| 9.3. |
1.5. 病毒之確定 (Typing of Virus) |
| |
亦即血清中和試驗 (Serum neutralization test),分離之病毒必須先測定其力價,求出其 TCTD50,而後將 100 TCID50 之病毒與等量之已知抗血清 (Antiserum,此已知之抗血清必須含有 20 倍中和 100 TCID50 之力價,例如 × 160 之 Anitserum 能中和 100 TGID50 之病毒,則我們使用 × 8 之 Antiserum 於此試驗 ),於此試驗必須同時使用數種已知之抗血清分別作中和試驗,病毒抗血清之混合液,以及病毒對照,分為三組,分別各置於 37℃,25℃ 和 4℃ 1~2 小時後取出接種於感受性之組織培養細胞,可中和病毒阻止 100TCID50 之病毒在細胞發育之抗血清,即可確定該病毒。 |
| 9.3. |
1.6. 血球凝集性 (HA) 或血球吸著性 (HAD) 病毒之確定: |
| |
有些病毒可以凝集哺乳類或禽類之紅血球 (例如 Influenza viruses),又有些可吸著紅血球 (例如 Parainfluenza viruses) 這些病毒在組織培養細胞通過數代後可增強其血球凝集性及其產生 CPE 之能力,要確認此病毒可用上述之血清中和試驗或可用較簡便之血球凝集抑制反應 (Hemagglutination-inhibition tests)。 |
| 9.3. |
2. 病毒之定量: |
| 9.3. |
2.1. 50﹪終點計算法 (50﹪end point): |
| |
50﹪end point 是一種病毒劑量的表示法,依據所接種之對象判定方法之不同,又可以用數種不同的表示法,如 LD50 (50﹪Lethal dose)即為可引起所接種之動物 50﹪死亡的病毒數量,LD50 (50﹪Infection doses) 即可引起接種之動物 50﹪受染性的病毒劑量,TCID50 即可引起所接種之組織培養 50﹪發生細胞變性之病毒劑量。 |
| |
| 1). |
TCID50 之計算 (Reed-Muench method) |
| |
要測定力價之病毒作 10 倍階段稀釋,每個稀釋接種 8 面 ( 或管 ) 的組織細胞,每面 ( 管 ) 接種量 0.1ml,每天觀察有無 CPE 或 Syneytium 發生 ( 二者為病毒發育之表徵 ),連續觀察 7~10 天 ( 或是觀察到病毒發育至最大限量為止 )。其計算法如下表: |
| |
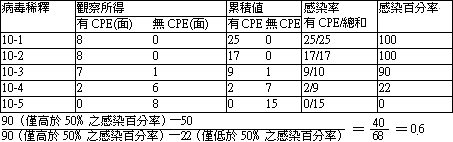
由以上公式求得 0.6 加到僅高於 50﹪感染率稀釋指數 ( 此例中為10-3 )得10-3.6<即為病毒作10>-3.6稀釋後每 0.1ml 含 1 TCIP50,亦即該病毒之力價為 10-3.6/0.1ml。 |
| 2). |
ID50 之計算 |
| |
ID50 之計算與 TCID50 完全相同,但依接種動物或胚胎是否受感染而判定,感染與否之判定標準如家兔在接種豬瘟病毒之熱反應,雞胚胎接種新城雞瘟後血球凝集等。 |
| |
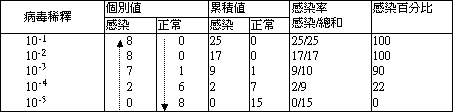 |
| |
計算公式同 TCID50 |
| 3). |
LD50之計算 |
| |
計算方法與前兩者完全相同,惟其判定標準係以接種動物或胚胎是否斃死判定之。 |
|
| 9.3. |
2.2. Plaque Method: |
| |
本法是基於一個病毒只能產生一個 Plaque 的原理來測定病毒之力價,亦即能應用於可在組織培養細胞產生 Plaque 的病毒定量。要測定的病毒作十倍稀釋後,各稀釋接種二面組織培養細胞 ( 直徑 6 公分 Petri dish 之每面接種 0.4ml,容量 3oz 的培養瓶接種量以 0.2ml 為宜 ),接種之細胞 37℃ 一小時讓病毒吸著,隨後以含 Agar 和 Neutral red 之培養液重層 (Agar overlay) 置室溫待 Agar 硬化之後,放回孵卵器,繼續 3~5 天後,計算 Plaque 數,病毒之力價即以 Plaque-forming units。 |
| |
Per ml (PFU/ml) 表示之

病毒稀釋 10-5.82 後每 ml 含 1PFU 之病毒,亦即病毒力價為 105.82PFU/ml。 |
| 9.3. |
3. 病毒之保存 |
| |
一般保存法 |
| 9.3. |
3.1. 一般注意: |
| |
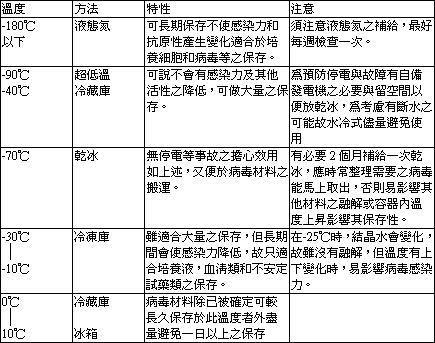
作有關病毒學方面之實驗,其病毒株保存的好壞,實關係著實驗的成效,近年來由於低溫保存技術上的進步,將病毒材料大量保存而定期作實驗仍可得一定病毒量已非難事,或是可以於不同時間取材保存而後才同時來測定病毒。對於保存之溫度及機器等之優劣點列表如下: |
| |
|
| |
病毒株之保存,應將最好條件下繼代所得之材料,保存於最好之條件下,保存時應有記錄簿做詳盡之記錄,記錄事項應包括: |
| 9.3. |
3.1. 毒株之名稱: |
| 9.3. |
3.2. 毒株之來源(分讓之研究室名.毒株從何種材料上分離,繼代於何種動物,繼代數,有關該毒株分離狀況之參考文獻等。) |
| 9.3. |
3.3. 分讓年月日: |
| 9.3. |
3.4. 分讓之材料:( 如感染漿尿膜 30% 乳劑 50% 甘油食鹽水之感染小白鼠腦等。) |
| 9.3. |
3.5. 分讓後在該實驗室繼代時之狀況,繼代者姓名,繼代數。 |
| 9.3. |
3.6. 繼代採材後之保存方及保存數 (Ampule數等 )。 |
| 9.3. |
3.7. 若分讓他人時記錄其住址及年月日。 |
| |
毒株之繼代應在仍存有充分材料及仍有充分感染力時行之,毒株之斷種被視為實驗研究者之恥。為保存病毒材料必須了解各種病毒之特性,而選擇適當之方法與適當之安定劑 (Stabilizer),通常病毒對低溫乾燥抵抗力較強,pH7.0~7.6 ( 弱鹼性安定,對酸性,高溫抵抗力弱,又在蛋白濃度高之液體中比較安定 )。 |
| 9.3. |
3.2. 感染臟器或體液之保存法: |
| |
| (1) |
直接保存法:感染價達到最高時採取之臟器或體液 ( 如動物之腦、肝、肺、脾、孵化蛋之漿尿膜尿液等 ),直接放入試驗管或小瓶內密封後低溫條存,-25℃ 或更低溫之冷庫保存較好。 |
| (2) |
使用甘油之方法:病毒在甘油內比較安定,感染臟器放入 50% 甘油食鹽水內後,於 -25℃ 以下之低溫保存,50﹪甘油食鹽水係甘油與 PBS 等量混合後高壓滅菌 15lb, 20') 存放臟器之容器亦須密封為佳,使用時可將臟器取出,以滅菌過之 PBS 充分洗滌後於乳缽內磨碎使用。 |
|
| 9.3. |
3.3. 感染臟器乳劑之保存法: |
| |
感染臟器做乳劑時比不做乳劑 ( 臟器本身 ) 時不安定.所以做乳劑用之稀釋液須慎重選擇,常用的有 PBS,(pH7.4~7.6) 加 2~10% 正常血清 ( 家兔,馬、牛等 )、broth,pepton,或少量 (0.1~1%) 之 gelatin、血清白蛋白,蛋黃脫脂奶等,又如 glutamic acid 與蔗糖溶液亦常被使用,保存之材料儘量使用濃度高者,乳劑之凍結採急速凍結對病毒力價之損害較少,如放在 acetone 乾冰液內急速凍結後低溫保存,使用時採急速融解置於 30℃ 左右溫水槽內以減少沈澱發生。 |
| 9.3. |
3.4. 凍結乾燥法: |
| |
是一種能長期而安定的保存病毒的方法,被廣泛的應用,它是利用乳劑在凍結的情況下抽真空使乳劑內之水分昇華,而成含相當低水分含量之粉末,隨之密封容器,使該粉末狀材料處於真空狀態,在缺水缺氧情況,停止其新陳代謝作用,能得長久保存病毒。 |
| |
凍結乾燥乳劑內之添加物依病毒之種類和各研究者之不同使用之種類很多。選擇添加劑的兩原則是必須對病毒有良好的保護作用及乾燥效果良好。較常使用的有脫脂奶,正常血清,broth,pepton,glucose,lactose,等作成各種濃度使用,但糖類,amino acid 等如濃度高則乾燥時速度慢,在乾燥過程中會有融解的現象,效果即差,配製乳劑所用溶液其鹽類濃度亦要不太高較好。 |
| |
|
| 9.4. |
細胞培養及其繼代 |
| |
1936年,Sabin 及 Olitsky 首次利用人胎兒神經組織培養分離 Polio 病毒成功而開組織培養之先河。近代病毒與研究的重大成就,其最主要原因為組織培養技術的發展成功。今試舉腎臟、胎兒肺臟及雞胚胎組織培養方法於後,其他動物之細胞培養方法亦大致類同。 |
| 9.4. |
1. 初代腎臟細胞培養 |
| |
| 材料: |
新鮮腎臟 |
| |
EMEM,growth medium ( 或其他培養液 )
PBS- ( Ca++ 及 Mg++Free )
0.25% Trypsin in PBS-
無菌鑷子、剪刀等器具
無菌外科手套
無菌平皿、圓筒或燒杯等
細胞培養用角瓶、試管等
消化瓶、電磁攪拌器
37℃ 恆溫水槽、酒精燈或本生燈
無菌注射筒 |
| 方法: |
| 1. |
快速消化法 (Rapid trypsinization method) |
| |
| a. |
以無菌之鑷、剪刀或戴上無菌外科手套將腎臟取下,置於無菌圓筒或燒杯內。如果腎臟需經輸送或經一段時間後方能處理,則在圓筒或燒杯內應加入少許緩衝液及適量抗生素等,並將其置於 4℃ 冰箱內。 |
| b. |
以消毒水拭淨工作實驗台。 |
| c. |
將腎臟取出,置於無菌平皿內,除去外面之脂肪、莢膜,再將每小葉的皮質部份剪下,剪成 4.0㎜ 左右小塊。 |
| d. |
將剪碎之腎臟小塊置於消化瓶中。 |
| e. |
加入 10 倍量的 PBS-,在 37℃ 水槽中攪拌 5 分鐘,把上層液倒掉,以把死亡、受損之細胞、血球、結締組織去掉。 |
| f. |
加入 10 倍量的 0.25% Trypsin,攪拌 10 分鐘,再把上層液倒掉。 |
| g. |
加入 10 倍量的 0.25% Trypsin,攪拌 10 分鐘後,取出一點消化中之細胞在顯微鏡下觀察。如果細胞還呈一串長條狀,則繼續消化,一直到由 5、6 個細胞集團出現時,始行收穫。 |
| h. |
把上層細胞傾入離心管內,以 1,000rpm,離心 5 分鐘。 |
| i. |
用 Growth medium 把沉澱細胞沖散,置於 4℃ 冰箱或冰水中。 |
| j. |
繼續以 0.25% Trypsin 消化,一直到細胞量足夠為止。 |
| k. |
收穫的細胞經四層無菌紗布過濾,以除去過長的細胞團。 |
| l. |
濾過細胞繼以 1,000rpm,離心 5 分鐘,將較輕的單細胞除去。 |
| m. |
沉澱細胞以生長培養液,配成 0.5% 左右細胞混懸液,分裝培養。 |
|
| 2. |
過夜消化法 (Overnight typsinization method): |
| |
a~f 步驟與上法同。
| |
將洗淨之腎臟,連同消化瓶、電磁攪拌器搬入 4℃ 冰箱中 ( 在電磁攪拌器與消化瓶之間需置一平皿以隔絕電磁器所產生的熱 ),緩緩攪拌之,經驗可告訴你攪拌器攪拌所需時間,而 Trypsin 濃度亦可自行調整。 |
| h. |
若不用電磁器,則可於翌晨取出消化瓶,在 37℃ 水槽中攪拌之。 |
| i. |
細胞之收獲,培養與上法同。 |
|
|
|
| 9.4. |
2. 初代肺臟細胞培養: |
| |
| 材料: |
新鮮胎兒肺臟
其他必備器具其如同腎臟的細胞培養。 |
| 方法: |
| a. |
以無菌解剖刀將胎兒放血,再把胸口切開,曝露肺臟。 |
| b. |
以無菌鑷剪,或戴上無菌外科手套取下胎兒肺臟置於無菌筒或燒杯內。如果需要輸送或經一段時間後方能處理,則應與腎臟一般處理。 |
| c. |
d. e. f. 步驟與腎臟細胞培養同,但肺臟細胞培養所需要的是單個細胞,而非細胞集團,每次消化收獲時間以實際情況而定。 |
| g. |
收獲細胞以 2,000rpm 離心 5 分鐘,以生長培養液沖散沈澱細胞,並置於 4℃ 冰箱或冰水中。 |
| h. |
繼續消化剩餘肺組織,一直到收獲細胞足夠為止。 |
| i. |
以四層紗布濾過沈澱細胞。 |
| j. |
以Neubaver血球計算盤,計算細胞濃度,將細胞濃度調節至 200.000/ml,分裝培養,分裝時宜用注射筒、pipetting aid 或用安全吸球 (Propipete) 分裝,不可用嘴。 |
| |
|
| |
附 表 |
| |
各種細胞之培養液及可繼代之代數 |
| |
| 細胞種類 |
培養液 |
可繼代代數 |
| 增殖 |
維持 |
| Diploid Cell Cultures |
|
|
|
| 牛胎腎、氣管、皮膚、小腸或胎兒 |
Hanks' LHY + 10﹪serum |
Hanks' LHY+ 2﹪serum |
約 20 或更多 |
| 牛胎兒甲狀腺或睪丸 |
Hanks' LHY + 10﹪serum |
Hanks' LHY + 2﹪serum |
約 8 或更多 |
| 馬腎 |
Modified EMEM + 10﹪fetal calf serum |
Hanks' LHY + 2﹪fetal calf serum |
約 5 或更多 |
| 豬胎腎或皮膚 |
Hanks' LHY + 10﹪serum |
Hanks' LHY + 2﹪serum |
不一定往往很多代 |
| 牛腎 |
Hanks' LHY + 10﹪serum |
Hanks' LHY + 2﹪serum |
約 30 或更多 |
| 狗腎或貓腎 |
Hanks' LHY + 10﹪serum |
Hanks' LHY + 2﹪serum |
約 5 或更多 |
| 老鼠胎兒皮膚 |
Hanks' LHY + 10﹪serum |
Hanks' LHY + 2﹪serum |
不一定往往很多代 |
| 兔腎 |
Hanks' LHY + 10﹪serum |
Hanks' LHY + 2﹪serum |
約 5 或更多 |
| 雞胚胎 |
Hanks' LHY + 10﹪serum |
Hanks' LHY + 2﹪serum |
|
| 雞胚胎 |
F-10 + M199 + 10﹪ fetal calf serum |
F-10 + M199 + 2﹪fetal calf serum |
約 3 或更多 |
Cell lines
Rk-15 (pig kidney) |
Hanks' LHY + 5﹪serum |
Hanks' LHY + 2﹪serum |
連續繼代 |
| Vero (African Green Monkey kideny) |
Hanks' LHY + 10﹪serum |
Hanks' LHY + 2﹪serum |
連續繼代 |
| EBTr (embrynoic bovine trachea) |
Hanks' LHY + 10﹪serum |
Hanks' LHY + 2﹪serum |
連續繼代 |
| MDBK (bovine kidney) |
Hanks' LHY + 10﹪serum |
Hanks' LHY + 2﹪serum |
連續繼代 |
| MECK (canine kidney) |
Hanks' LHY + 10﹪serum |
Hanks' LHY + 2﹪serum |
連續繼代 |
|
| |
註:可用 Eagle's MEM 或其他培養基取代 Hank's 培養基。 |
|
| |
| 1×PBS-配方: |
| NaCl |
8.0 公克 |
| KCl |
0.2 公克 |
| Na2HPO4.12H2O |
2.89公克 |
| KH2PO4 |
0.2 公克 |
| 純水 |
1.0 公克 |
| 120℃,1Kg/㎝2 高壓滅菌 |
|
| TV配 方: |
NaCl
KCl
Na2HPO4
KH2PO4
Trypsia (1:250)
EDTA
2﹪phenol red
純水
攪拌至溶,以 0.2μ 濾過膜過濾之。 |
|
|
| |
(三) 雞胚胎細胞培養 |
| |
| 材料: |
9 日齡雞胚胎 |
| |
其他必備器具如同腎臟細胞培養。 |
| 方法: |
| a. |
以燈光照射雞蛋確證胚胎仍然活著。 |
| b. |
以消病毒水、碘酊等拭擦氣室部份的蛋殼,並以無菌鑷剪,剪開氣室部份的蛋殼。 |
| c. |
以無菌鑷子撥開各層膜,夾住胚胎頭部,取出胚胎置於平皿內。 |
| d. |
將胚胎的頭部、腳、內臟移走,只留下軀幹並將其剪成 2㎜ 大小,置於消化瓶中。 |
| e. |
f.g.h.i.j 步驟與胎肺臟細胞培養同。 |
|
|
| |
(四) 繼代細胞 (Cell strains) 與株化細胞 (Cell lines) 之繼代培養 |
| |
| 材料: |
各種不同的生長培養液 |
| |
Trypsin Versene (TV),PBS-,離心管等。 |
| 方法: |
所用之 PBS.TV 及生長培養液應先加溫至 37℃ |
| |
| a. |
倒棄原有的培養液,用 PBS- 清洗細胞層一次,把 PBS- 倒棄。 |
| b. |
加入 Trypsin Versene (250ml 角瓶加 10ml)。 |
| c. |
數分鐘後以橡膠刮子 (Rubber policeman, Scraper) 輕輕將細胞層刮下,再以無菌注射筒沖散。或直接用注射筒把細胞層沖散。 |
| d. |
把沖散的細胞層置於離心管內,以 2,000rpm,離心 5 分鐘。 |
| e. |
以生長培養液沖散細胞,分裝培養。 |
|
|
| |
(五) 細胞的保存 |
| |
| 材料: |
繼代細胞或株化細胞 |
| |
含 15% 牛血清及 10% 甘油 (Glycerol) 或亞碸二甲基 (Dimethyl sulfoxide, DMSO) 之生長培養液。 ( 註:加入 DMSO 時會產生熱,故應冰溶之 ) |
| |
小玻璃安瓶或塑膠膠螺旋蓋瓶。 |
| |
絕緣盒子。 |
| 方法: |
| a. |
把細胞層依上述方法 (2) 消化,離心沈澱之。 |
| b. |
以含有 15% 牛血清及 10% 甘油或 DMSO 之生長培養液沖散成細胞濃度約 107/ml 的細胞混懸液。 |
| c. |
將細胞分裝於安瓶內,以火焰封瓶。若用塑膠瓶則不必封瓶,分別標明細胞日期後,置於 rack。每支安瓶 1ml。 |
| d. |
裝有細胞之 rack 置於絕緣盒子內,先把此盒子置於 4℃ 冰箱 2 小時。 |
| e. |
再移置於 -30℃,2 小時;然後再移置於 -75℃ 冰箱內。 |
| f. |
翌晨再把 rack 移置於液態氮內。
( 註:如採用 DMSO 時,可直接將絕緣盒子置入-75℃ 冰箱 4 小時,然後把 rack 移置於液態氮內。 ) |
|
|
| 9.4. |
6. Mycoplasma 污染細胞培養之預防 |
| |
污染細胞培養的 mycoplasma 其主要來源是口腔,所以在細胞培養過程中凡用到吸管時應以 propipete ( 安全吸球 ) 或使用 Pipetting aid 操作而不可以口腔行之。但有些抗生素,如 200μg/ml 之 kanamycin, chloramphenicol 50μg/ml,200μg/ml 之 neomycin 等對 mycoplasma 之預防均極為有效,其他的抗生素如 50μg/ml 之 aureomycin 亦很有效。 |
| 9.4. |
7. Mycoplasma 從受污染的細胞除去的方法 |
| |
游離狀態的 Mycoplasma 對多種抗生素均具敏感性,但細胞培養一旦受到 mycoplesma 污染之後,甚難把它消滅掉,下述方法可以一試: |
| |
| 1. |
用蒸餾水製備含 1,000μg/ml aureonycin,1,000μg/ml kanamycin 及 250μg/ml chloramphenical 之低滲抗生素液 (Hypotonic antibiotic solution) |
| 2. |
將上述低滲抗生素液加入受污染的細胞,浸泡 2~5 分鐘。 |
| 3. |
再用含上述各抗生素 1/5 濃度的生長培養液培養之,而且每 2~3 分換液一次,共換液 2~3次。 |
| 4. |
然後再用含 5μg/ml aureomycin 之生長培養液培養。
( 註:其他抗生素如 Tylosin,Lincospectin 亦可採用 ) |
| 參考文獻: |
| 1. |
鍾明華等,1977:獸醫實驗室檢查手冊,PP157-189,台灣省家畜衛生試驗所編印。 |
| 2. |
Lennette, E. H. et al, 1971:Diagnostic procedures for viral and rickettsial infections, 4th Edition, PP1-178。 |
| 3. |
Rovozzo, G. C. and Burke, C. N.:A manual of basic virological techniques, PP1-125。 |
|
| 9.4. |
8. 豬白血球培養 |
| |
豬隻固定
( 豬鼻固定器 ) |
| ↓ |
| 採 血 |
| 採血部位 ( 如頸部等 ) 以碘酒及酒精消毒,以十八號針頭採血,使血液流入已滅菌含玻璃珠之脫纖瓶內 |
| ↓ |
| 脫 纖 |
| 搖動脫纖瓶連續十分鐘以上,到纖維素析出為止。 |
| ↓ |
| 過 濾 |
| 通過兩層紗布漏斗以去除玻璃珠和血液中纖維,加入抗生素 ( 盤尼西林 100u/ml,鏈黴素 100μg/ml),每 50ml 血液足夠做一培養盤。 |
| ↓ |
| 離 心 |
| 於室溫 4℃,800g 離心 30 分鐘。 |
| ↓ |
| 抽取白血球 |
| 以注射筒和長針,先取出上層血清保留備用,再小心抽取白血球層,放入 15ml 之透明離心管,加先前取出之上層血清至全量 12ml 後上下抽動,以沖散白血球。 |
| ↓ |
| 離 心 |
| 於 4℃,800g 離心 30 分鐘。 |
| ↓ |
| 小心抽取白血球層,放入保留備用之血清內,做成白血球懸浮液。 |
| ↓ |
| 分 裝 |
| 分裝於 24 孔塑膠培養盤內每孔 0.4ml 或於 48 孔培養盤,每孔 0.2ml。 |
| ↓ |
| 培 養 |
| 於 37℃,5% CO2 之培養箱內培養。 |
|
| 9.4. |
9.豬肺臟巨噬細胞之製備 |
| |
楊揚輝.陳聖怡
|
| 9.4. |
9.1. 肺臟之採取 |
| |
選取 2~6 週齡健康 SPF 小豬,麻醉 ( 或電昏 ) 後剖腹,切斷後大動脈放血後解剖,以無菌止血鉗夾住咽喉頭處氣管,小心取下心肺,置無菌操作盤備用。 |
| 9.4. |
9.2. 肺巨噬細胞之收集 |
| |
| (1) |
以無菌止血鉗夾住下端氣管,剪去其上之氣管,插入無菌注射筒 ( 或漏斗 )。 |
| (2) |
以 150ml 細胞培養液*灌入肺臟,輕輕按摩後,自氣管倒出,以離心管收集之。反覆灌洗 6 至 8 次。
*細胞培養液皆含有 10% 胎牛血清及一般量之 5 倍抗生素與制黴劑之 MEM。 |
| (3) |
收集細胞沖洗液,以雙層細濾網過濾。 |
| (4) |
將所得之細胞濾液離心收集 (4℃、280g、13 分鐘 )。 |
| (5) |
棄上清液。以 10ml 細胞培養液*沖散沉澱。收集所得之細胞懸浮液,離心 (4℃、280g、13 分鐘 )。反覆沖洗 3 次。 |
| (6) |
以 10ml 細胞生長液*懸浮最後一次離心所得之沉澱。 |
| (7) |
取 0.1ml 細胞懸浮液以 PBS 適當稀釋混和後,加入等量之 Trypan Blue 水溶液**,混和均勻。
**Trypan Blue 水溶液:
1.60g Trypan Blue 粉末 + 100 ml 生理鹽水泡製備用。 |
| (8) |
吸取適量混合液,滴入細胞計數盤,計算大而光亮之細胞顆粒 ( 藍色顆粒為死細胞 )。所得每 1㎜2 之平均細胞數以下列公式計算之,即得細胞總數。
巨噬細胞總數 =1㎜2 之平均細胞數 × 計算室和蓋玻片之間隔逆數 × 稀釋倍數。
例如稀釋 20 倍後,1㎜2 中有 40 個細胞,則:
巨噬細胞總數 = 40 × 10 × 20 = 8,000 ( 個 /㎜3) = 8.0 × 106 ( 個 /ml) |
| (9) |
視培養目的,再依下表之規範稀釋分裝。 |
| |
 |
| (10) |
分裝後置 37℃,5% CO2 恆溫箱內培養備用。 |
|
| 9.4. |
9.3. 冷凍保存 |
| |
| (1) |
以含 10% DMSO 及 20% 胎牛血清之 MEM 將細胞稀釋成 1.5×107 個/ml後分裝於安瓶內。 |
| (2) |
先將安瓶置 4℃ 2 小時冷卻,而使於 -70℃ 冷凍一夜再移入液態氮桶內保存。 |
|
| |
|
| 9.5. |
END 法檢測豬瘟病毒 |
| |
楊揚輝.黃天祥 |
| 9.5. |
1. 初代豬睪丸細胞 (Primary Swine Testicle Cells;ST): |
| |
以無菌操作技術取下 4~6 週齡健康小豬睪丸,經去莢膜、剪碎,並以 0.01MPBS,PH7.2 和 0.25% 胰蛋白酶液各洗過一次後之組織碎塊,再以 0.25% 胰蛋白酶液於細胞消化瓶內在磁力攪拌器上,室溫攪拌消化 10~15 分鐘。細胞消化液,需先經 150mesh 濾網過濾後加入 1/10 倍量之 56℃,30 分鐘非酶化處理小牛血清,並置 4℃ 冰箱中。剩餘之組織塊,再重複予以消化,直至全部被消化掉為止。最後,將收集得之細胞濾液經 4℃,1,000rpm 離心 5 分鐘。沉澱細胞再以含 10% 胎牛血清 ( 無 BVD 抗體 )、抗生素 (Penicllin G Sulfate 100 U/ml 和 Streptomycin 100μg/ml) 和抗黴素 (Fungizone 250 μg/ml) 之 MEM 細胞培養液 (Minimum Esential Medium,Eagle Base) 泡製成約 4.0 × 106 Cells/ml 的豬睪丸細胞懸浮液。 |
| |
| 註: |
0.25% 胰蛋白酶液配製法 |
| |
秤取胰蛋白酶粉沫 30g ( m Gibco,1:250 ),溶於 3,000ml 之 0.01M,PBS,pH7.2 溶液內。置 -20℃ 冷凍保存,即為 1﹪胰蛋白酶原液。使用時,先經解凍後再以 0.01M PBS,PH7.2 泡製成 0.25﹪胰蛋白酶液 (1% 胰蛋白酶原液:PBS=1:3)。 |
|
| 9.5. |
2. 病毒: |
| 9.5. |
2.1. 新城雞瘟病毒 (NDV): |
| |
宮寺株新城雞瘟病毒係以雞胚胎囊腔內接種增殖。10~11 日齡雞胚胎,在照蛋燈光透視下,選擇接近氣室邊緣,避開血管處,拭以碘酊消毒,打洞,再拭以碘酊。以 26 gauge 5/8 inch 長之針頭,採腔與蛋平行方向插入約 1/2 inch,並將病材 0.2ml 注入尿囊腔內。蛋孔以臘密封,置孵卵器內進行病毒增值。每日照蛋收集斃死胚蛋 ( 接種後 24 小時內死亡之胚蛋丟棄不收集 ),收取尿囊液。經 4℃ 3,000rpm 離心 30 分鐘後,小量 (1ml) 分裝於試管內並置 -70℃ 冰凍保存,同時以血球凝集反應 (HA) 測定其血球凝集力價。使用時再以細胞培養液稀釋成 1HA 單位備用。 |
| 9.5. |
2.2. 病材乳劑之製作 |
| |
剖檢病畜,以無菌刀剪採取扁桃腺、淋巴結及脾臟等病材 ( 若不馬上進行檢測,應置-70℃ 冰凍保存備用。)。稱重後,置無菌研缽內,加入適量無菌玻璃沙,以杵磨成乳狀。以 10 倍病材重量之含 10% 小牛血清及 5 倍抗生素之 MEM 沖洗收集之。再以 4℃、3000rpm、離心 20 分鐘,取上清液經 0.45um 濾膜過濾後備用。 |
| 9.5. |
3. 操作法 |
| |
| (1) |
將病材乳劑以細胞生長液 (Growth Medium) 由 10-1 至 10-3 作 10 倍連續稀釋。於 96 孔塑膠細胞培養盤第 1、2 列中,每孔放入未稀釋病材乳劑 0.025ml,第 3、 4 列每孔放入同量之 10-1 稀釋倍數病材乳劑為,以此類推,直至第 7、8 列每孔放入 10-3 稀釋倍數病材乳劑為止,而第 9~12 列各孔則加入 0.025ml 之細胞生長液,以作為新城雞瘟病及細胞之對照用。 |
| (2) |
上述 96 孔微量塑膠培養盤,每孔再加入 0.1ml 之初代豬睪九細胞液 (4 × 105 個細胞 ),然後放置 37℃,5% CO2 孵卵器內培養 4 天。 |
| (3) |
經吸去培養液後,第 11、12 列每孔加入細胞生長液 0.1ml 作為正常細胞之對照,其餘各列則每孔加入 0.1ml 的宮寺株新城雞瘟病毒液 ( 1 HA 單位 ) 攻擊,再放置 37℃,5% CO2 孵卵器內培養 3 日。 |
| (4) |
每天觀察細胞情形並以第 3 天為最終判讀。第 9~12 列之對照組應均不出現細胞病變 (CPE),即均為陰性反應,其餘各列若出現 CPE 者則為陽性,否則即為陰性。至於陽性病毒力價之測定,可參閱第十一章豬瘟中和抗體 END 測定法中 " 豬瘟病毒力價之測定 " 的內容。 |
| (5) |
判讀時,若量太多而不便使用顯微鏡觀察,則可用 0.5﹪結晶紫甲醇溶液固定染色十分鐘,以自來水沖洗乾淨後觀察之。 |
|
| |
註:0.5﹪結晶紫甲醇溶液配法如下: |
| |
| 結晶紫 (Crystal Violet) |
0.5 g |
| 70﹪甲醇 (Methanol) |
100.0 ml |
| 完全溶解後即可使用。 |
|
| |
|
| 9.5. |
4. 豬瘟病毒 END 法之力價測定 |
| |
(單位:ml) |
| |
 |
| |
|
| 9.5. |
5. Reed-Muench Method 之 TCID50 計算方法如下表: |
| |
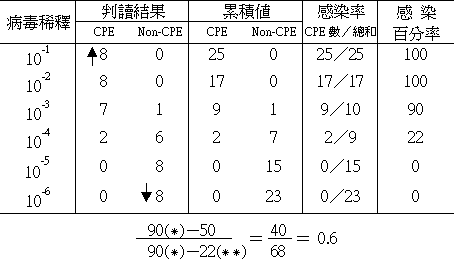 |
| |
*僅高於 50﹪之感染百分率
**僅低於 50﹪之感染百分率 |
| |
由以上公式求得之 0.6 加到僅高於 50﹪感染率的稀釋指數 ( 比例中為 10-3) 得 10-3.6 即該病毒之感染力價為 10-3.6 TCID50/0.025ml。 |
| |
|
| 9.6 |
間接免疫酵素斑點染色法(IIPS) |
| |
黃天祥 |
| 9.6. |
1. 操作法: |
| |
| 1. |
PK-15 和 RK-13 株化細胞先以滅菌之 PBS 洗 3 次除去血清蛋白後以 0.25% 胰蛋白酵素 (TVS) 混合 EDTA (0.02%) 在 37℃,10 分鐘,從角瓶消化下來,馬上以含 10﹪牛血清之 MEM 培養液與細胞液混合而使其停止消化,並以 800rpm,10 分鐘離心分離,並以含 10% 胎牛血清及抗生素之 MEM 作成細胞懸浮液。( 原細胞培養瓶面積:欲培養之面積 =1:3)。 |
| 2. |
PK-15 和 RK-13 細胞懸浮液分裝於 24 孔組織培養盤,每孔 1ml,並置於 37℃,5% CO2 恆溫器內培養 2~3 天。 |
| 3. |
等細胞長滿後,將細胞生長液甩棄,並於接種經 10 倍連續稀釋之病材乳劑 0.4ml/孔。PK-15 細胞用於豬瘟之檢測,假性狂犬病則以 RK-13 細胞為之。 |
| 4. |
於 37℃,5% CO2,恆溫器內感作 1 小時,不必搖動。 |
| 5. |
甩去病毒接種液,並於每孔加入 1ml 的 0.7% Agarose-MEM ( 配法如后所述 ),並待凝固。 |
| 6. |
倒置放於 37℃,5% CO2 恆溫器內培養,豬瘟檢測培養 3 天,豬假性狂犬病 2 天。 |
| 7. |
將細胞培養盤放入 4℃ 冰箱 30 分鐘。取出,以藥匙末瑞或外科刀片挖出 Agarose,並馬上將培養盤細胞層以吹風機吹乾。 |
| 8. |
每孔加入 1.0ml 之 PLP 固定液或 10% 中性福馬林液,於室溫固定 10 分鐘。 |
| 9. |
固定後以 PBS 快洗 2 次,浸洗 1 次 ( 浸泡 10 分鐘後甩棄 PBS)。若不立即染色應以蒸餾水洗淨、乾燥,並以封條密封,置-70℃ 冰櫃保存。 |
| 10. |
將標準抗血清 ( 若有單源抗體更佳 ) 經 PBS 適當稀釋後,分別加入病毒感染細胞盤內,每孔 0.4ml。 |
| 11. |
於室溫中感作 30 分鐘,以 PBS 沖洗 2 次,取後 1 次以 PBS 浸泡 10 分鐘,甩棄 PBS。 |
| 12. |
於每孔加入 0.4ml 預先測定且已適當稀釋之山羊抗豬 IgG 過氧酵素標示抗體 (Caprine Anti-Swine IgG-Horseradish Peroxidase Conjugate,一般稀釋成 2~4 單位 )。 |
| 13. |
於室溫中感作 30 分鐘,以 PBS 洗 3 次,最後 1 次以 PBS 浸泡 10 分鐘,甩棄 PBS。 |
| 14. |
於每孔加入 0.4ml 受質,直至斑點呈色後,甩棄受質,以自來水洗去,晾乾後觀察,出現斑點灶者即為病毒分離陽性,至於所分離病毒之力價測定,可計算斑點灶之總數,其算法可參考第十一章間接免疫酵素斑點染色法的計算部分。 |
|
| 9.6. |
2. 染色試劑之配方: |
| 9.6. |
2.1. 0.7% Agarose-MEM 配法: |
| |
| 2 × MEM ( 含 NaHCO3) |
80 ml |
| 胎牛血清 |
20 ml |
| Fungizone |
500 ml |
| Gentamycin |
10 ml |
|
| |
混合均勻後置水浴槽內加溫至 45℃ 時再加入 100ml 經溫高壓溶解滅菌 30 分鐘後之等溫的 1.4﹪Agarose*,充份混合後備用。 |
| |
*1.4% Agarose 配法: |
| |
| Agarose |
1.4 g |
| 蒸餾水 |
100.0 ml |
|
| 9.6. |
2.2. PLP 固定液配法: |
| |
| m-Sodium Periodate(0.21369q/100ml) |
0.01 M |
| Lysine Buffer (Ph=7.4)* |
0.1M |
| Paraformaldehyde |
1.0 % |
| *Lysine Buffer 配法: |
|
| 0.2 M Lysine Monohydrochloride (3.654g/100ml) |
100.0 ml |
| 0.1 M Na2HPO4 (1.496g/100ml) |
100.0 ml |
| 以磁力攪拌器混合後以 HCl 調整 pH 至 7.4;每週新配或使用前過濾。 |
|
| 9.6. |
2.3. 10% 中性福馬林液為美國 Fisher 公司製品。 |
| 9.6. |
2.4. 配法: |
| |
| NaCl |
80.0 g |
| KCl |
2.0 g |
| Na2HPO4 |
11.5 g |
| KH2PO4 |
2.0 g |
| 溶入 10 公升 DDW 中,並調整 pH 值至 7.3,滅菌後使用。 |
|
| 9.6. |
2.5. 受質: |
| |
下述兩種受質皆適本法之用,染色時擇一為之。 |
| |
| (1) |
將 10mg 之 3.3' -Diaminobenzidin 溶於 10ml PBS 含有 0.01﹪H2O2。本受質呈色後,斑點為咖啡色。 |
| (2) |
A.B.C. 受質 (ABC Substrate)。本受質之染色斑點呈粉紅色。 |
| |
4.5 ml Acetate Buffer*,pH=5.2
0.3 ml AEC Stock Solution**
0.06ml 0.3% H2O2
混和均勻後過濾供用。
* Acetate Buffer (0.1M pH=5.2)
取 21ml 0.1 N 醋酸液 @ 加 79ml 0.1M 醋酸鈉液 @@,並互調 pH=5.2。時用時應配新。
@ 0.1 N 醋酸液
6.0ml 冰醋酸加蒸餾水至 1000ml,使成 0.1 N 醋酸液,保存於室溫。
@@0.1 M 醋酸鈉液
13.6gm 醋酸鈉 (Sodium Acetate-3H2O) 加蒸餾水至 1000ml,使成 0.1 M 醋酸鈉液,保存於室溫。 |
|
| |
**A.E.C. Stock Solution:
30mg 之 3-Amino-9-Ethylcarbamizol 溶於 7.5ml 之 N, N Dimethyl formamide,放於 10ml 有色瓶內,置-20℃ 保存備用。 |
| |
|
| 9.7. |
免疫過氧 單層細胞檢測法 (IPMA) 單層細胞檢測法 (IPMA) |
| |
黃天祥 |
| 9.7. |
1. 操作法: |
| |
| 1. |
取無菌平底 96 孔細胞培養盤,每孔加入 0.1ml 豬肺臟巨噬細胞液 ( 2 × 106 個細胞/ml),於 37℃ 5% CO2 恆溫器中培養 2 小時。 |
| 2. |
每孔加入 0.05ml 以細胞生長液行 10 倍稀釋之病材乳劑,覆蓋膠膜,置 37℃ 5% CO2 恆溫器中培養 2~5 天。 |
| 3. |
當 10~20% 細胞發生細胞變性 (CPE) 時取出,甩棄培養液,以含 0.1% Tween 20 之 PBS(PBS-T) 快洗 1 小時,浸洗 1 次 (* 每次浸泡5分鐘 ) 後甩乾,置 37℃ 暖房 1.5 小時乾燥。若培養 5 天後仍無細胞變性發生,需繼代 3 次以確診。 |
| 4. |
完全乾燥後,每孔加入 0.1ml 4% 福馬林液,於 4℃ 固定 15 分鐘 ( 或於-20℃ 以 80% 丙酮固定 45 分鐘 )。 |
| 5. |
甩棄固定液,以 PBS-T 快洗 1 次,浸洗 2 次 * 後甩乾,置 37℃ 暖房 1.5 小時乾燥。 |
| 6. |
每孔加入 0.05ml 稀釋液,置 37℃ 恆溫器內 30 分鐘使飽和。 |
| 7. |
以 PBS-T 浸洗 2 次 * 後甩乾,加入 0.05ml 陽性血清稀釋液 ( 事先以稀釋液行 50 倍稀釋 ),於 37℃ 感作 45 分鐘後甩棄。 |
| 8. |
以 PBS-T 浸洗 4 次 * 後甩乾。 |
| 9. |
加入適當稀釋的山羊抗豬 IgG 結合酵素 (Goat Anti-Swine IqG-Peroxidase Conjugate) 0.05ml,於 37℃ 感作 45 分鐘。 |
| 10. |
甩棄酵素液,以 PBS-T 浸洗 4 次 * ,甩乾。 |
| 11. |
每孔加入 0.05ml 受質,於 37℃ 作用 15~20 分鐘。 |
| 12. |
甩棄未作用之受質以 PBS-T 浸洗 2 次 *。每孔加入 0.1ml PBS-T,於光學顯微鏡下判讀。細胞內有紅色受質者為病毒陽性,其力價之測定可依第十一章豬瘟中和抗體 END 檢測法中的 Reed-Muench Method 之 TCID50 計算方法行之。 |
|
| 9.7. |
2. 本法所需各項試劑之配法: |
| 9.7. |
2.1. 細胞生長液: |
| |
| 10 × MEM ( 含 NaHCO3) |
50 ml |
| 胎牛血清 |
50 ml |
| Fungizone |
500μg |
| Gentamycin |
10 mg |
| 無菌蒸餾水 |
440 ml |
|
| |
混合均勻後置 4℃ 冰箱備用。 |
| 9.7. |
2.2. 稀釋液:含 10% 胎牛血清及 2% Casein 的 PBS 溶液。 |
| 9.7. |
2.3. PBS-T: |
| |
| Tween 20 |
0.5 ml |
| PBS |
500.0 ml |
|
| 9.7. |
2.4. 受質之泡製: |
| |
| 3 Amino-9-Ethyl Carbazol |
2.0 mg |
| N, N-Dimethylformamide |
0.3 ml |
| 醋酸緩衝液 @ |
5.0 ml |
| 9﹪雙氧水 (H202) |
0.01 ml |
|
| |
於不透明玻璃瓶中混和均勻後備用。 |
| |
@ 醋酸緩衝液: |
| |
取 0.58g 醋酸鈉 (Sodium Acetate Anhydrous--CH3COONa) 加 200ml 蒸餾水,完全溶解後,再以 1N 醋酸 (Acetic Acid--CH3COOH) 調整酸鹼度至 PH=5。 4℃ 保存備用。
☆ 本劑為致癌劑,請戴手套於抽氣裝置下小心操作。 |
| |
|
| 9.8. |
聚合酶鏈反應診斷法 |
| |
聚合酶鏈反應 (PCR) 技術是藉著聚合酶,在兩個方向相反的寡核苷酸引動子 (Primer) 協助之下,將二個引動子之間特定的 DNA 片段反覆複製,這種複製是以幾何級數的倍數增加,可在短短數小時之內,將目標 DNA 放大至百萬倍之多,又因其放大對象為核酸,故不會受抗體生成的影響,因此這一技術已為研究生物科技及病毒學者所熱衷使用。 |
| |
可以應用 PCR 方法來檢測的樣品基多,包括組織、血液、病毒液、唾液、喉鼻液及糞尿等;而樣品量只要 100 毫克或 100 微升即可,但如果檢體是糞便的話,則需先經處理,方可進行 PCR 檢測。 |
| |
要應用 PCR 技術,首先就必需要有該病原的核酸序列,經選定特異性的引動子後,即可執行病原核酸萃取。在萃取核酸時,包括二種:一種為 DNA 核酸,另一種為 RNA 核酸,DNA 核酸的萃取較簡單,只要以等量的 Phenol-Chloroform 溶液與樣品充分混合,溫和震盪一分鐘後,再冰浴十五分鐘,經 4℃,10000g 離心二十分鐘,將水層轉置於另一支經高溫高壓滅菌的微量管中,加入 2-5 倍的純酒精,置於 -20℃ 冰箱經一晚上,就可依上述離心條件處理,乾燥後即得核酸;至於 RNA 核酸的萃取方法,可參考第十五章第三節之 RNA 核酸萃取步驟。 |
| |
核酸萃取之後,如果是 RNA 核酸,則需先經反轉錄作用製成 cDNA ( 其方法可參照第15.3.5. 之第一股 Cnda 製備 ) 再進行 PCR 測試;( 其方法可參照 15.3.5. 之 PCR 反應 ):若是 DNA 核酸,則可直接進行 PCR 反應,其方法可參閱 15.3.4.,而反應條件也需依各種病原之不同另行建立之。 |
| |
對於 PCR 反應後之產物分析及鑑定,可參閱 15.3.6. 之 PCR 產物電泳分析及 15.3.7. 之 PCR 產物之鑑定。 |
| |
|
| |
參考文獻: |
| |
| 1. |
Hess W.R. and DeTray,D.E. (1960) The use of leukocyte culture for diagnosing African swine fever(ASF)Bull. Epiz. Dis. afr. 8, 3l7. |
| 2. |
Malmquist,W.A. and Hay,D. (1963) Hemadsorption and cytopathic effect produced by African swine fever virus in swine bone marrow and buffy coat cultures. Amer. J. Vet. Res. 24, 450. |
| 3. |
Pan, I.C., Hung, T.S. and Hess,W. R. (1982) New method of antibody detection by indirect immunoperoxidase plaque staining for serodiagnsis of African swine fever. J, Clin. Microbil. 16:650-655. |
| 4. |
Yechiei Becker. 1987. Development in veterinary virology;African swine fever. Martinus Nijhoff Publishing, Boston. |
| 5. |
Wensvoort, G. ,Terpstra, C. , Pol. J. M. A. , Ter Laak. E. A. ; Bloemrad, M. , De Kluyver, J. M., Moonen, P. L. J. M., Zetstra, T., De Boer, E.A., Tibben, H. J., De Jong, M. F.,Van't Velt, P., Groenland, G.J.R., Van Gennep, J. A. Voets, M. T., Verheuden, J. H.M., and Braamskamip. J, (l991a). Mystery swine disease in the Netherlands : The isolation of Lelystad virus. Vet. Q. 13, 121-130 |
| 6. |
Komaniwa, H., Fukusho, A. and Shimizu, Y. 1981. Micromethod for performing titration and neutralization test of hog cholera virus using established porcine kidney strain. Natl. Anim. Hith. Quart., 21, 153-1 58. |
| 7. |
Kumagai, T., T. Shimizu, S. Ikeda, and M. Matumoto. 1961. A new in vitro method (END) for detection and measurement of hog cholera virus and its antibody by means of effect of HC virus on Newcastle disease virus in swine tissue culture. I. Establishment of standard procedure.
J. Immunol. 87, 245-256. |
| 8. |
Matumoto, M., T. Kumagai., T. Shimizu, and S. Ikeda. 1961. A new in vitro method (END) for detection and measurement of hog cholera virus and its antibody by means of effect of HC virus on Newcastle disease virus in swine tissue culture. II. Some characteristics of END Method.
J. Immunol. 87, 257-268. |
| 9. |
Shimizu, T. et al, 1964. A new in vitro method(END) for detection and measuerment of hog cholera virus and its antibody by means of effect of HC virus on Newcastle disease virus in swine tissue culture. III. END neutralization test. Arch. Ges. Virusforsch. 14:215-226. |
| 10. |
S.S. Lai; W.C. Ho; T.S. Huang;S.K. Wan and T.C, Lin. 1978. A simple and rapid microtiter procedure for END Method to determine Hog Cholera antibody titers.J. Chinese Soc. Vet. Sci. No. 2:109-111. |
| 11. |
Afshar, A., and G.C. Dualc. 1986. Immunoperoxidase plaque staining for the detection of Pseudorabies virus. Can.J. Vet. Res., 50:118-119. |
| 12. |
Kumagi, T., T, Shimizui, S. Ikeda, and M. Matumoto. 1961. A new in virto method(END) for detection and measurement of hog cholera virus and its antibody by effect of HC virus on Newcastle disease virus in swine tissue culture. I, Establishment of standard procedure. J. Immumol., 87:245. |
| 13. |
Pan, I.C., T.S.Huang and W.R. Hess. 1982. New method of antibody detection by indirect immunoperoxidase plaque staining for serodiagnosis of African swine fever. J.Clinical Micro., 16:650-655. |
| 14. |
Tracy T.C. Lin and Robert C.T. Lee. 1981. An overall report on the development of a highly safe and potent lapinized hog cholera virus strain for hog cholera control in Taiwan. NSC Spec. Publ. 5:1-44. |
| 15. |
Wensvoort, G., Terpstra, C., Pol, J.M.A., Ter Laak, E.A. Bloemrad, M., De Kluyver, E.P., Kragten,C., Van Buiten. L., Den Besten, A., Wagenaar, F., Broekhuusen, J.M., Moonen, P.L.J.M., Zetstra,T., De Boor, E.A., Tibben, H.J., De Jong, M.F., Var't Velt, P., Groenland, G.J.R., Van Gennep, J.A.Voets, M.T., Verheuden, J.H.M., and Braamaskamp.J. (1991a). Mystery swine disease in the Netherlands:The isolation of Lelystad virus. Vet.Q.13, 121-130. |
| 16. |
陳瑞英、周德源. 1987. 膠體電泳分析 DNA 片段. 電泳分離技術研討會論文集研討會專集 (九):P87-91. |
| 17. |
Kawasaki, E.s. 1990. Sample Preparation from Blood, Cell, and other fluids. In "PGR Protocal" (ed. by Micheal A. Inni, David H. Gelfand, John J. Sninsky, Thomas J White), P146-152. Academic Press. Inc, San Diego. |
| 18. |
Rusell. H. 1989. Simple and Rapid Preparation of Samples for PCR. In "PCR Technology" (ed. by H. A. Erich), P31-38. Stockton Press, NewYork. |
| 19. |
Higuchi, R. 1989. Rapid, Efficient DNA Extraction for PCR from Cells or Blood. Perkin/Cetus Newsletter Amplifications 2:1. |
| 20. |
Chomczniski, P., and Sacchi, N. 1987. Sigle Step Method of RNA Isolation by Acid Guanidinium Thiocyanate-Phenol-Chloroform Extraction. Anal. Biochem. 162:156-159. |
| 21. |
Krug, M. and Berger, S.L. 1987. First-strand cDNA Synthesis Primed with oligo (dT). In "Guide to Molecular Cloning Techniques" (ed. by Berger, S.L. and Kimmel A.R.), P316-325. Academic Press, INc. San Diego. |
| 22. |
Przybyla, A.E. and Chirgwin, J.M. 1987. Isolation of RNA using Quanidium Salts. In "Guide to Molecular Cloning Techniques" (ed. by Berger, S.L. and Kimmel A.R.), P219-227. Academic Press , INc, San Diego. |
| 23. |
Sambook J. Fritsch E.F., Maniatis T. In Vitro Amplification of DNA by the Polymerase Chain Reaction. In "Molecular Cloning:A Laboratory Manual, 2nd edition (3 vols)". Ch.14. Cold Spring Harbor Laboratory Press. |
|
 液以無菌注射筒或毛細管採取,立即以脫脂乳或組織培養液稀釋,置入冰箱中。病材在輸送過程一直到接種於適當宿主止,其間接應保持在冷的狀態下。
液以無菌注射筒或毛細管採取,立即以脫脂乳或組織培養液稀釋,置入冰箱中。病材在輸送過程一直到接種於適當宿主止,其間接應保持在冷的狀態下。

 (Nucleasea)之反應:
(Nucleasea)之反應: 將病毒與核酸分開,如 DNA 病毒則用 RNase,RNA 病毒則用 DNase 除去污染之核酸。
將病毒與核酸分開,如 DNA 病毒則用 RNase,RNA 病毒則用 DNase 除去污染之核酸。





 單層細胞檢測法 (IPMA)
單層細胞檢測法 (IPMA)