| 10.1. |
血球計數 |
| 10.1. |
1.紅血球計數 |
| |
紅血球之計數,用血球計數器,血球計數器有二吸管及一計算盤,血球計算盤一般皆用厚玻璃裂成,血球計算盤有多種,常用者有 A. Thoma,B. Tuerk,C.Fuchs-Rosental,D. Neubauer,E. Improved Nenbauer。 |
| 10.1. |
1.1.血液稀釋:紅血球計數用之稀釋液為: |
| |
| a. |
Hayem's fluid 其成份為: |
| |
| 氯化汞 |
Mercuric Chloride |
0.5 gm. |
| 硫酸鈉 |
Sodium Sulphate |
5.0 gm. |
| 氯化鈉 |
Sodium Chloride |
1.0 gm. |
| 蒸餾水 |
Distilled water |
200.0 cc |
|
| b. |
生理食鹽水 Physiolgical salt solution |
| |
方法:
| (1) |
取紅血球計數器內的吸血管 ( 採用球形膨大部上方有 101 刻度之吸管 ), 吸血管須清潔乾燥,吸取血液至 0.5 刻度處,吸時宜緩而勻,如吸時有氣泡入管則須重做。 |
| (2) |
用濾紙迅即擦去粘附於吸管尖端周邊部之血液,插吸管尖瑞入稀釋液,吸稀釋液入吸管,吸時輕輕旋轉吸管,並將吸管置於垂直的位置,以防大氣泡進入球形部份。待稀釋液吸至 101 刻度處後取出吸管。 |
| (3) |
將橡皮管取下,分別以右手拇指和中指堵塞吸管二瑞,極力振盪約一分鐘。使血液和稀釋液充分混和。 |
|
|
| 10.1. |
1.2計數 |
| |
紅血球稀釋液準備妥善後先吹去 2~3 滴,拭乾吸管之尖端然後將吸管之尖端觸蓋玻片及計算盤中間部份之相接處,吸管內之液體因毛細管之吸引作用而進入蓋玻片下。進入蓋玻片下之紅血球稀釋液不宜過多,否則蓋玻片浮起,由此計得之紅血球數即增多,若流入計算盤之紅血球稀釋液之量適宜,則幾全部位於蓋玻片下,不至遍及凹溝,且亦無氣泡,如無此種良好之結果,此步應重作。
略待數分鐘俟紅血球穩定後,以低倍數顯微鏡檢查紅血球分佈是否均勻,如分佈不勻,則須拭淨計算盤,重行滴入紅血球稀釋液。
一切預備完畢後,以高倍顯微鏡計數紅血球,同時調節聚光鏡使光線適宜。
[ 圖 ] 改良 Neubauer 計算盤 (Improved Neubauer Counting Chamber) 如圖於四角及中央各選一中格計五格 ( 每一中格有 16 格 ) 計算其紅血球的數目,記錄於簿上,五中格計算完畢後,計得 80 小格的總數,又血球如恰在格線上者,則取拾規則均須一律。
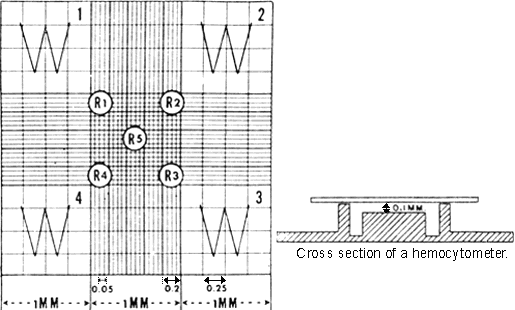
|
| 10.1. |
1.3.計算法: |
| |
如設此數為E時,每 1㎜3 中之總數 X 可由下式算出,
400
X = E × ----- ( 全部之小格 ) ÷0.1 ( 蓋玻片至計算盤之深度 ) × 200 ( 稀釋倍數 )
80
= E × 10,000
操作時除逐部注意,以防發生錯誤外,下列各點亦常為計數不準確的原因:
| (1) |
進入吸管之血液過多或過少或釋度不確。 |
| (2) |
操作過慢致使一部血液凝固。 |
| (3) |
稀釋液配置過久內有酵母細胞與血球混淆。 |
紅血球計算完畢後,吸管及計算盤須立即洗淨,吸管可按序用水,70%,80%,95% 酒精、乙醚清洗。洗時可用口吸上述液體入吸管,然後吹去,但以橡皮球或唧筒較佳,因用口時呼氣內的水分常附著於吸管內壁。倘吸營內有凝血塊附著,可用馬尾通出,然後用濃硫酸洗淨或置吸管於盛酸液之試管內過夜。計算盤用潔淨之軟布沾水拭後擦乾即可。
|
正常禽畜的紅血球數目 ( 百萬/㎜3)
|
|
馬
|
6.5~9.4 |
豬
|
5.0~9.0 |
猴
|
4.8~6.2 |
|
兔
|
4.5~7.0 |
鴨
|
2.8 |
牛
|
5.4~9.0 |
|
水牛
|
5.4~7.4 |
犬
|
6.4~8.0 |
火雞
|
2..24~2.37 |
|
鵝
|
2.71 |
綿羊
|
8.5~13.5 |
貓
|
6.2~10 |
|
雞
|
2.8~4.5 |
山羊
|
12.5~22 |
|
|
|
| 10.1. |
2.白血球計數 |
| |
白血球計數亦用前述之血球計算器,計算盤常用 Neubauer 及 Turk。Neubauer 氏計算盤方格刻度區域有 9 平方粍 (Sq,㎜)中央之方格係用做紅血球之計算。 |
| 10.1. |
2.血液稀釋: |
| |
白血球計數用之稀釋液為:
Acetic acid 2c.c
1﹪Gentian violet 1c.c
Dist H2O ad. 100c.c
或 Acetic acid 1c.c. Dist H2O 加到 100c.c.
( 此稀釋液能破壞紅血球,為除去酵母細胞及黴菌起見,用時應過濾 )
取球形膨大部上方的刻度為 11 之吸管 ( 白血球吸管 ),吸血液至刻度 0.5 處,再吸取稀釋液至刻度 11 處,於是血液被稀釋 20 倍,其操作如紅血球計數法。 |
| 10.1. |
2.2.計數及計算法: |
| |
搖勻先吹去 2~3 滴,以 1 滴滴於計算盤上,在高倍顯微鏡 (200X) 下計算,如圖四角 W 處之四大格之白血球總數因每一大格為 1㎜2,故四大格為 4㎜2 ,而稀釋倍數為 20。 |
| |
設四大倍中之白血球總數為 W,則每 1㎜3 血液中之白血球數 X |
| |
X = W ÷ 4 ÷ 0.1 × 20
= W × 50
|
正常禽畜的白血球數目 ( 1,000 /㎜3)
|
|
馬
|
5~11(6~12) |
綿羊
|
5~12(9~10) |
|
犬
|
6~20 |
牛
|
4.5~13(7~10) |
|
山羊
|
5~13 |
貓
|
8~35 |
|
水牛
|
8.2 |
豬
|
8.6~20(11~16) |
|
猴
|
8~25 |
雞
|
20~40(30) |
|
| |
Ⅲ鳥類白血球辨認及計數: |
| |
| (Ⅰ) |
白血球辨認:
| (1) |
假嗜伊紅性球:相當於哺乳動物的嗜中性球,核多葉面細胞質內有紅色長卵圓形晶體狀顆粒。 |
| (2) |
嗜伊紅性球與哺乳動物的伊紅性球相同,其細胞質內顆粒成圓球形,呈磚紅色。 |
| (3) |
嗜鹼性和哺乳動物無大差異,單核球亦然,惟鳥類單核球的細胞質多混濁且內有空泡。 |
|
| (Ⅱ) |
白血球分類計數:血片製備、染色法、辨算法均和哺乳動物者完全相同。 |
| (Ⅲ) |
白血球計數法:鳥類白血球與有核紅血球不易區別,須用間接方法計算白血球數目,其法如下:
| (1) |
染色液配法,玫塊紅 (Phloxine) 50mg,蟻醛溶液 5ml,林格 (Ringer) 氏液 95ml。 |
| (2) |
取紅血球計數時所用吸血管,吸取血液至 0.5 記號處,用上述染色液稀釋 200 倍。 |
| (3) |
將此吸血管靜置數小時。 |
| (4) |
充分搖動吸血管,然後滴入計算室。 |
| (5) |
將計算室全部 (9平方㎜ ) 的假嗜伊紅性球及嗜伊紅性球計數。 |
| (6) |
依 Ⅱ 法分別得假嗜伊紅性球,嗜伊紅性球,嗜鹼性球,淋巴球,單核球的百分比。 |
| (7) |
依下法計算得白血球數:
| 白血球數 = (計算室上所得假嗜伊性球及嗜伊紅性球數目) × 10 ÷ 9 × 200 × |
100
-------------------------------------------------------
(染色片上假嗜伊紅性球百分
比及嗜伊紅性球百分比之和) |
|
|
|
| 10.1. |
3.血小板 ( 栓球 ) 計數 |
| |
因血小板甚易破壞,且其頗強之粘著性,常附著於異物或相互間粘附於一處,故計數頗為困難,是以難以避免之誤差自較紅血球或白血球之計數為大。然以其數目之變度大,故除計數時數目相差過巨外,實用上對於此等誤差並不重視。 |
| |
用以計算血小板之方法很多,以血球計算器直接計數血小板數目較由間接法所查得者為低。
| Ⅰ |
直接法 (Direct Method)
| (1) |
黎艾二氏法 (Method of Rees and Ecker)
此法所用的稀釋能保留紅血球,故可於同一樣本作紅血球之計數,稀釋液之成分如下:
| 枸橡酸鈉 |
Sodium citrate |
3.8gm |
| 40.0% 甲醛 |
Formaldehyde |
0.2 ml |
| 煌甲酚藍 |
Brilliant cresyl blue |
0.1gm |
| 蒸餾水 |
Distilled water |
100.0ml |
為免血小板菌集故須快動作操作,先用潔淨紅血球吸管吸取稀釋液至刻度 0.5 處,然後自穿刺部位吸取血液至 1 之處,最後立即吸取稀釋液至刻度 101 處,血液稀釋之倍數為 200,立刻搖動吸管 2 分鐘,使血液與稀釋液混合,迅即置入計算盤,待 10 分鐘,用高倍顯微鏡如計算紅血球計算血小板,所計算全部小格內的血小板數目乘以 2,000 即得每 ㎜3的血小板數目。 |
| (2) |
蓋李二氏法 (Method of Guy and Leake ) 與上法同但所用之稀釋不同。
| 蒸餾水 |
Distilled water |
94.00 c.c |
| 40﹪福馬林 |
Formalin |
6.00 c.c. |
| 草酸鈉 |
Sodium oxalate |
1.6 gm |
| Crystal violet |
|
0.01gm |
配置後加熱、過濾,然後貯於有塞瓶中。 |
|
| Ⅱ |
間接法 (Indirect Method)
此處係採用方氏法 (Method of Fonio),試劑為 14﹪硫酸鎂 (Magnesium sulphate) 即以硫酸鎂 14gm 溶解於 5Oc.c. 蒸餾水中,再稀釋至 100c.c. 製成。
其法以醚或酒精拭被檢查者之取血部位,置 14% 硫酸鎂溶液一滴於此部位,以 針經硫酸鎂溶液刺破皮膚,待血液流出後,以穿刺針將血液與硫酸鎂溶液混合, 直至約 1 份之血液比 9 份之硫酸鎂溶液為止。取此混合液 1 滴置於載玻片,做成血液塗片。持其乾燥,以甲醇 (Methyl alcohol) 固定 5 分鐘在空氣內乾燥。用稀薄之 Giemsa's stain ( 每 c.c. 水加 2 滴 ) 染 1 小時,用中性蒸餾水沖洗後,乾燥置於顯微鏡下,在連續移動塗片中,計數所有之紅血球及血小板,至紅血球數至 250 個。記錄紅血球及血小板之數目,如法計數四個不同區城,按以下公式算出 1㎜3 血液之血小板數目。
被檢查者每立方耗血液之紅血球數
-------------------------------------------------- × 數得之血小板數
1000
=1㎜3血液中之血小板數
|
正常時的血小板數目(百萬/㎜3)
|
|
馬
|
0.9~4.1 |
豬
|
0.12~0.72 |
兔
|
0.54 |
|
牛
|
0.3~0.8 |
犬
|
0.2~0.6 |
雞
|
0.2~0.1 |
|
綿羊
|
0.25~0.75 |
豬
|
0.15~0.25 |
|
|
|
|
| 10.1. |
4.嗜伊紅血球計數 |
| |
計算嗜伊紅血球之方法有二:
| Ⅰ |
直接法 (Direct Method)
| 1. |
亨氏法 (Direct of Hinkelman)
其法與白血球之計數同,但稀釋液用下列溶液:
| 黃伊紅 |
Yellow eosin |
0.5gm |
| 濃福馬林 |
Conc. formalin |
0.5c.c. |
| 酚 |
Phenol |
0.5c.c. |
| 蒸餾水 |
Distilled water |
100c.c. |
此法嗜伊紅血球之顆粒染成黑色,置普通之血球計數盤在低倍顯微鏡下即可以計數。 |
| 2. |
派氏法 (Method of Pilot)
所使用之稀釋液之成分為:
| Propylene glycol |
50c.c. |
| Distilled water |
40c.c. |
| 1% Phloxine |
10c.c. |
| 10% Na2CO3 |
1c.c. |
碳酸鈉能溶解嗜伊紅血球以外之任何白血球,但應用稀釋液之濃度超過 0.1% 時則嗜伊紅血球亦將被溶解,稀釋液配製妥善後,在室溫內可放置一個月其法以二白血球吸管,吸取血液至刻度 1.0 處,再吸上述染液 ( 即稀釋液 ) 至刻度 11 處。搖動 30 秒鐘後,靜置 15 分鐘以待其他白血球之溶解及嗜伊紅血球之著色,然後再搖動 30 秒鐘,以每吸管內之嗜伊紅血球稀釋液置計算盤上 2~4 次,各計數 9 平方粍 (sq. ㎜) 內嗜伊紅血球之數目。以各盤 9 平方耗所得數目相加除以計數之盤數,即得深為 0.1㎜ 9 平方粍之嗜伊紅血球數,再乘以 1.11 即得深為 0.1㎜ 之 10 平方粍之嗜伊紅血球數,然後乘稀釋液倍數 10 得 1 立方粍 (Cu.㎜) 血球內嗜伊紅血球之數目。換言之,每 1㎜3 血液內之嗜伊紅血球數即等於各盤之平均數乘 11.1。 |
|
| Ⅱ |
間接 (Indirect Method)
即以染色之血液塗片計數 500 個白血球,並同時數當時所見之嗜伊紅血球,然後以下式計算:
被檢查者每立方耗血液之白血球數
------------------------------------------------- × 數得之嗜伊紅血球數
500
=1㎜3 血液中之嗜伊紅血球數
|
|
| 10.1. |
5.網織球計數 |
| |
成熟的紅血球內,尚留有細胞核的殘餘物成網狀稱網織球,僅可以下述方法染出之。 |
| 10.1. |
5.1.改良的奧威氏 (Osgood-Wilbelm) 法。 |
| |
| (1) |
置 1% Brilliant cresyl blue 生理鹽水溶液 5~10 滴於小管中。 |
| (2) |
加等量勻和的血液,搖動使完全混合。 |
| (3) |
置室溫內 15 分鐘。 |
| (4) |
用玻棒滴此混合液一小滴於載玻片上。 |
| (5) |
置一大蓋玻片於其上;徐徐壓下使液體成一薄層。 |
| (6) |
用油鏡檢查成熟的紅血球呈淡黃綠色,圓盤狀,網織狀的大小和顏色和成熟的紅血球相同,但網織球內有紫色顆粒,白血球呈淡藍色,血小板似無色而成盤形,內有藍色顆粒。 |
| (7) |
檢查幾個視野後,如有網織球存在,則先隨意擇一視野,注意每視野內紅血球及網織球數目,當數完 500 紅血球後,即將網織球數用百分比表示之。如 500 紅血球中有 5 網織球時即為 1﹪。 |
|
| 10.1. |
5.2.變 (Alternate) 法,( 染色片須保存時用之 ) |
| |
| (1) |
將 Brilliant cresyl blue 用乙醇配成 0.5% 溶液。 |
| (2) |
將乾淨載玻片上的一端,滴上述溶液二滴並使乾。 |
| (3) |
置血液一滴於同一區域,用一火柴梗將血液和溶液充分混合。 |
| (4) |
用另一玻片與上述玻片成一銳角,拉成一血片,如普通製備血片然。 |
| (5) |
再用 Wright stain 染色。 |
| (6)、(7) 與上述第一項目同。 |
|
| 10.1. |
5.3.新美藍 New Methylene Blue 法 |
| |
| 染色液: |
新美藍 0.5gm,草酸鉀 1.6gm,蒸餾水 100ml |
| 方 法: |
置二滴血液及同量染色液於小試管中使作用 15~20 分鐘後做成薄血片。 |
| 計 算: |
用油鏡檢查時網織球呈藍色,故無須做其他後染色,其計算如上法仍以 500 紅血球中之網織球以百分比表示之。 |
正常網織球範圍。
豬 0.5~4.5%,牛 0% 偶有一個,犬 0.2~2.0%。
綿羊 0% 偶有一個,貓 0.2%,山羊 0% 或偶有一個。
猴 0.3%,馬 0% 或偶有一個。 |
| |
|
| 10.2. |
血球像之觀察 |
| 10.2. |
1.血片製作 |
| |
欲製得優良之血液塗片,須注意 (1) 載物玻片及蓋玻片須非常清潔。
新玻片須浸於 10% 醋酸溶液中,然後以蒸餾水沖洗,乾燥後備用。舊玻片如有 Cedar oil 須用 Xylol 除去,然後用肥皂水清洗,或用肥皂水煮沸,洗去肥皂,置於新鮮配製之 1:1000 硝酸溶液或潔淨液中過夜,洗淨後再用酒精拭之。用潔淨抹布擦洗備用。 (2) 血滴不宜過大。 (3) 動作須迅速,必須在血液開始凝固前操作完畢。
血滴之大小,常視製作血片之目的而定,用作紅血球之檢查宜作成薄片,大部分塗片上之紅血球成單層,互相緊接而不重壘即可。用作白血球之分類計數時,以紅血球均勻重壘成串為較佳。因此種血片在一定區域所見之白血球數較多,可以縮短計數時所耗費之時間,但血片之厚薄不應至辨認白血球亦感困難之程度。 |
| 10.2. |
1.1.載玻片法 (The Two Slide Method) |
| |
以右手拇指及食指持潔淨之載物玻片,於其一端內方 3/4 吋處,沾血一小滴,注意玻片僅沾及血滴,而勿觸及皮膚,以免染有上皮細胞。
以第二載物玻片之一端置於第一載物玻片血滴之近處,使兩載物玻片相對面成 30°~40° 之角度,將第二載物玻片端移至血滴內,血液立即沿玻片端之邊緣擴散,遍及兩載物玻片接觸之處。
推第二載物玻片向第一載物玻片之另一端,血液即隨之塗佈於第一載物玻片上。血滴之厚薄由改變兩載物玻片所成之角度,使用之壓力,血滴之大小之不同而異,血片製作畢,即置於空氣中乾燥或以手持玻片室溫乾燥之。 |
| 10.2. |
1.2.蓋玻片法 (Ehrlich's Two Cover Glass Method) |
| |
以一潔淨之蓋玻片觸血滴,然後以有血滴之面向下置於另一蓋玻片上,倘血滴不過大,旦蓋玻片潔淨,血液即於兩蓋玻片間成一薄層,在血液停止擴散及開始凝固前,立即將兩蓋玻片置一平面上分開。
此法在白血球分類計數時頗堪推薦,因在血滴內所有白血球全可見於此兩蓋玻片,故可避免分類計數時白血球分佈不均之弊病。 |
| 10.2. |
2.血片的染色 |
| 10.2. |
2.1.賴特染色 (Wright's Stain) |
| |
| (1) |
因賴特染色內含有甲醇,故染色前不須固定,用吸管吸染液滴於血片上,使遮蓋血片之全部,染液應稍多以防蒸發及其後之色素沈澱。 |
| (2) |
1 分鐘後,以另一滴管如入等量之蒸餾水,加入蒸餾水之量可以滴數計算,使染液與蒸餾水混勻,血片上之液體不宜過多。否則將流出血片外。如此靜待 4 分鐘,長時之染色易生沈澱,嗜伊紅血球之顆粒在短時之染色亦易於染出。 |
| (3) |
在水中洗 30 秒鐘或洗至血片較薄之部份現黃或淺紅色為止。洗前稀釋之染液沈著於血片上時,應加水使染液浮去。倘在沖洗前持片傾去染液,常有浮渣沈著於血片上,此種浮渣雖經沖洗亦不易除去。 |
| (4) |
在火焰之高處移動染妥之血片以烤乾之,然後置於顯微鏡下用油鏡檢查。 |
|
| 10.2. |
2.2.金姆塞染色 (Giemsa's Stain) |
| |
血片先於甲醇內固定,然後浸於新鮮稀釋液之染液 ( 以原液 1c.c. 加蒸餾水 10c.c.) 內 20 分鐘或以上,為避免染液中之沈澱沾著於血片,常將載物玻片或蓋玻片垂直浸入染液中,亦有先加蒸餾水 30 滴於已固定之血片,再加 3 滴 Giemsa 原液,染 15~20 分鐘。血片染就後,可置於顯微鏡下用油鏡檢查。 |
| 10.2. |
2.3.嗜伊紅血球染色 |
| |
計述於前嗜伊紅血球計數內。 |
| 10.2. |
2.4.網織球染色: |
| |
亦詳述於前嗜伊紅血球計數內。 |
| 10.2. |
3.Diff-Quick 鑑別用血液染色液 |
| |
Diff-Quick 鑑別用血液染色液為如同 Wright's 染色,Giemsa's 染色同樣染色之迅速鑑別用血液染色液,15 秒即能快速染色,到目前為止,血液染色液可做得到的,本染色液都能做得到。
內容:Diff-Quick 固定液 500ml × 1
Diff-Quick 染色液 Ⅰ 500ml × 1
Diff-Quick 染色液 Ⅱ 500ml × 1
使用法:
將 Diff-Quick 染色液,分別倒入三個可以放得下血片之適當容器中。
| 1. |
將血片放入固定液中 5 秒鐘 ( 每一秒鐘上下晃動一下,共五次 ),再慢慢的從固定液中拿出來。 |
| 2. |
放入染色液 Ⅰ 中 5 秒鐘 ( 也同樣的每一秒鐘上下晃動一下,共五次 ),再慢慢的從固定液中拿出來。 |
| 3. |
放入染色液 Ⅱ 中 5 秒鐘 ( 再次同樣的每一秒鐘上下晃動一下,共五次 ),再慢慢的從固定液中拿出來。 |
| 4. |
用精製水沖洗。 |
| 5. |
風乾後鏡檢。 |
如果使用玻片籃,則可以多數血片,同時一次染色。
注意:
| 1. |
需要較濃染時候,染色液 Ⅰ、Ⅱ,浸潤秒數可以適宜增加。 |
| 2. |
需要較淡染色時,染色液 Ⅰ、Ⅱ,浸潤秒數可以適宜減少,但是如果少於 3 秒,是不行的。 |
| 3. |
嗜酸性染色需較強時,染色液 Ⅰ 浸潤的秒數可以適宜增加。 |
| 4. |
嗜鹼性染色需較強時,染色液 Ⅱ 浸潤的秒數可以適宜增加。 |
|
| 10.2. |
4.血片的檢查 |
| |
先用乾燥系高倍鏡 (400倍 ) 觀察全面,注意細胞種類數目,分佈是否均勻,染色狀態是否良好,然後改用油鏡系高倍鏡 (900~1500倍 ) 觀察紅血球,白血球等。 |
| 10.2. |
4.1.紅血球之檢查 |
| |
正常的末梢血液的紅血球示橙紅色之圓盤狀,中央較落,不含核、牛之 RBC 大小常有很大的差異而中央凹部不顯明,山羊之 RBC 甚小,而其周緣稍有凹凸, 正常的馬 RBC 極易形串錢狀 Roulean formation,鳥類之 RBC 呈卵圓形核,駱駝的 RBC 亦為卵型但無核。
| (1) |
大小的變化:
| a. |
正常紅血球 (Normocytes) 大紅血球 (Macrocytes) 小紅血球 (Microcytes) |
| b. |
紅血球之大小不同症 Anisocytosis |
|
| (2) |
形態的變化:
| a. |
Target Cell |
| b. |
球形紅血球 Spherocytes |
| c. |
變形紅血球 Poikilocytes |
|
| (3) |
染色性的變化:
正染色性紅血球 Normochromic erythrocyte
染色過多性紅血球 Hyperchromic erythrocyte
淡染色性紅血球 Hypochromic erythrocyte |
| (4) |
異常現象:
| a. |
嗜多色性 Polychromatophilia |
| b. |
鹼性班點 Basophilic stippling |
| c. |
Howell Jolly bodies |
| d. |
有核紅血球 Metarubricytes |
| e. |
網織血球 Reticulocytes |
| f. |
寄生蟲 Parasite |
|
|
| 10.2. |
4.2.白血球之檢查 |
| |
| a. |
大小 |
| b. |
.細胞質:
|
| c. |
細胞核:
| (1) |
形態 |
| (2) |
顏色 |
| (3) |
染色質構造 |
| (4) |
核仁 |
|
|
| 10.2. |
4.3.白血球之分數計算: |
| |
| (1) |
白血球數目之計算:
臨床上白血球數有明顯增減時才有意義,即明顯的增減,如以塗抹良好的血片,用中倍鏡 ( 約 200 倍 ) 觀察,紅血球不相壘的部位數視野 ( 這部位之選擇標準要自己決定,且每次選出相似的部位 ),且算每視野均有幾個白血球,經過數次與白血球計數過的數字對照,每視野平均幾個時表示正常,則以後不用計算白血球數即可算大概之情形。 |
| (2) |
白血球百分比之計算方法:
塗抹血片之起始都較厚,白血球有萎縮現象,而末端部則易變形成被破壞,又塗抹而之中心部易有淋巴球,近緣部份則易有單核球及顆粒球集中現象,故白血球百分比之計算應就紅血球無相壘之近末端約 1/3 部之白血球 100~300 個分類計算其百分比。 |
|
| 10.2. |
4.4.白血球絕對值及相對值: |
| |
| a. |
白血球分類計數,是以百分比表示,在血液中所含不同形態的白血球的相對值,由於某一種形態的白血球的百分比增加時,其可能表示此種白血球的數目確實的增加,或其他種白血球數目的減少,所以此種相對值常有錯誤的表示。 |
| b. |
各種白血球的絕對值是由所求得各種白血球的百分比乘以白血球總量。假如每 ㎜3 容積中,任何一種 Cell 總量增加,此即表示絕對值增加,然如僅其百分比增加,而其他 Type 減少,則表示相對值增加。 |
|
| 10.2. |
4.5.血小板的觀察: |
| |
| 1. |
估計血液中出現血小板的量與正常血中所見者比較,是否正常,增加或減少。 |
| 2. |
注意血小板大小及形態的差異。 |
|
| |
|
| 10.3. |
血紅素的測定 |
| |
血紅素濃度之測定,一般以百分數 (Percentage) 表示之血紅素計之種類甚多,不同種類之儀器其作為 100% 之標準又各不同,即同種之血紅素計亦有數種不同之標準,故應用時宜如注意。
實驗室應用之血紅素計,有下列數種,茲簡述之: |
| 10.3. |
1.直接比色法 (Direct Matching Methods) |
| |
常用者為 Tallqvist's,hemoglobin scale,此 Scale 係由若干頁之吸水紙及一頁孔之色度表構成之小冊,用此法甚不準確,但其操作極其簡便,在無其他儀器時多用之。其法為測驗時撕此小冊之吸水紙一小塊,自被檢查者耳垂沾血一滴,在未被空氣完全乾燥之前,置於色度表上比色,至吸水紙上血滴之色與色度表上某一標準色相同時,該標準色之 % 數,即為被檢查者之血液所含血紅素之百分數。 |
| 10.3. |
2.酸性血色質法 (Acid Hematin Methods) |
| |
其法亦有數種,係將血色素用稀鹽酸轉變為酸性血色質,然後將此褐黃色溶液與比色座 (Comparator) 或比色計 (Colorimeter) 上之標準管比色。
Sahli 血色計 Hemometer 具有不褪色之標準玻璃與方比色管,方比色管一側之刻度為 100c.c. 血液血色素之 gm 數,其對側為血色素之百分數,以每 100c.c. 血液內含血色素 14.5gm 為 100%。試驗時置 N/10 鹽酸 (Hydrochloric acid) 於比色管刻度 10 處,以血色素吸管用酒精消毒後之採血部位吸取血液至 20cumm 處,拭去血色素吸管尖端之餘血,吹入比色管之鹽酸內,並吸鹽酸入吸管內沖洗數次,血色素此時即變為酸性血色質,吹入比色管之鹽酸內,並吸鹽酸入吸管內沖洗數次,血色素此時即變為酸性血色質,以玻棒將比色管內之溶液攪勻,靜置比色座上 1 分鐘,然後滴水稀釋,於每次加水後攪勻,直至此色管內溶液之色與標準玻璃之色度完全相等為止。此時液面刻度之數字,即為血色素之濃度數值。此一實驗所用之 N/10 鹽酸,以濃鹽酸 1c.c. 加入 99c.c. 蒸餾水內即可應用。 |
| 10.3. |
3.光電比色法 (Photometric Method) |
| |
Rouy-photometer 此法勝於比色計法 (Colorimetric method) 及分光光度計法 (Spectrophotometric method),photometer 之價雖昂,但其用途廣,且操作簡便而準確。其法為。
以特製之血色素吸管 (Hemoglobin Pippet) 吸取血液至第一刻度 (0.025c.c.) 處,再吸取 0.1﹪碳酸鈉溶液至 5.025c.c. 刻度處,裂成 1:200 之氧合血色素溶液,然後以之盛入 Photometer 之 Absorption cell 內置 Photometer 上,自 Photometer 讀得一數字,查表即可得每 100c.c. 血液所含有血色素之 gm 數。
|
正常的動物血紅素量(gm/100ml 血液)。
|
|
馬
|
9.0~15 |
豬
|
10~14 |
兔
|
10~16 |
|
猴
|
9.0~15 |
公牛
|
9~14 |
水牛
|
11.7 |
|
綿羊
|
11~13 |
犬
|
13~18 |
雞
|
8~13 |
|
山羊
|
9~13 |
火雞
|
11 |
貓
|
8~12 |
|
| |
|
| 10.4. |
血球容積測定 |
| 10.4. |
1.方法:血球容積之測定有 Wintrobe 管法及微量法 Micro hematocrit 等法 |
| 10.4. |
1.1.溫氏法 (Wintrobe's Method) |
| |
最常用為血球容積測定,試劑用 0.8gm 之草酸鉀 (Potassium oxalate) 及 1.2gm 之草酸銨 (Ammonium oxalate) 溶於 100c.c. 蒸餾水中製成,其法為:將上述試劑 0.5c.c.( 含草酸鹽 Oxalate 10gm) 置於試管內,將水份蒸乾,置靜脈血 5c.c.,以毛細吸管移含草酸鹽之血液入分血管至 10cm 刻度處,加橡皮帽,置每分鐘轉動 3,000 次之遠心沈澱器內沈澱 20 分鐘,記錄其沈澱所得之讀數,繼續沈澱 10 分鐘,俾使其沈澱完全。以此時讀得之數字乘 10,即得每 100c.c. 血液中紅血球容積之百分數。 |
| 10.4. |
1.2.微量法:(Microhematocrit) |
| |
微量血計 (Micro hematocrit method) 係以長 75㎜ 及直徑約 2㎜ 內貯肝素之玻管吸取毛細管血液,在火焰上封閉後,置於 international micro-capilary centrifuge Model M.B 上沈澱 5 分鐘,然後將此毛細管置 Johnes Micro hematocrit reader 上即可讀取血球與血漿之比量,此法操作簡單迅速,且測驗所需血液量甚微。 |
| 10.4. |
2.應用 |
| |
| (1) |
血球容積為最能正確表示動物之血像。 |
| (2) |
血球容積為一很好的間接指示血液中之血紅素。 |
| (3) |
血球容積亦為一很好的血液中紅血球數目的指示。 |
| (4) |
狗血液中之紅血球總數,粗略值可由血球容積除 6 求得而由血球容積除 3 可約略求得血紅素值。 |
| (5) |
白血球數目亦可由遠心分離使紅血球層上之血沈棕黃層求得大略值。
| a. |
最初 1㎜ 相當於等於 10,000 而後每 0.1㎜ 相等於 2,000 白血球 1Cu,㎜ 之值。 |
| b. |
此僅為約略值廣被用做白血球總數之代替。 |
|
| (6) |
必需注意血漿層之顏色,且需熟悉每一種動物之正常顏色,由於其可指示膽紅素的出現。
| a. |
黃膽血漿,可能表示:
| (i) |
溶血情形-尤以在血球容積較正常低。 |
| (ii) |
肝疾病或膽管阻寒-常血球容積正常或增加。 |
|
| b. |
血漿色白或無色,且血球容積低時常表示骨紅血球製造受阻。 |
| c. |
血漿色灰或混濁可能表示脂血症。 |
|
|
| |
|
| 10.5. |
Sysmex F-800 血液學半自動分析儀 |
| 10.5. |
1.血球計數分類原理 |
| 10.5. |
1.1.血球計數原理 (RBC、WBC、platelet) |
| |
自動血球計數器,F-800,是利用電子阻抗自動檢測原理,而測定出紅血球 (RBC) 及白血球 (WBC) 之數目。
| (1) |
當新鮮血液經由稀釋液稀釋之後,使血球分佈在稀釋液中,而稀釋後之檢體在稀釋液與血球之間,產生極大差異之導電率,計算血球及其大小就是依據此導電率之差異而檢測出來。 |
| (2) |
經稀釋後之檢體,經由儀器之電極孔吸入,當每個血球通過電極孔之瞬間,稀釋液與血球之通過,則產生電阻值之差異。 |
| (3) |
儀器之電極具有內外二種不同極性之電極片,當儀器內部供應定值之電流,由內電極片流經至外電極外,利用歐姆定律 V ( 電壓 )=I ( 電流 ) X R ( 電阻 ),可得到因電阻值之變化而產生電壓值之改變。 |
| (4) |
在內外電極之微小電壓改變信號,送至高準位放大其信號然後經由截止電路切割、去除不必要之干擾信號,最後將血球真正的脈衝信號數,送往計數電路,將其結果在數字顯示幕上顯示出來。 |
|
| 10.5. |
1.2.Hct/MCV 測定原理 |
| |
儀器測定血容積比 (Hct) 及平均血球體積 (MCV),是利用血球之電子脈衝信號高度,而檢測出血球之體積。 |
| 10.5. |
1.3.Hb 測定原理 |
| |
Hb ( 血色素 )之測定使用 Sysmex 溶血劑 (Quicklyser),利用國際標準氰化血紅素法,將紅血球表面薄膜破壞,使釋放出血紅素,而經氧化後之變性血紅素轉換為氰化血紅素 (Cyanmethemoglobin) 或 Hemoglobin cyanide (HbCN),再利用光源測定吸光度以波長 540㎜,頻帶寬度 60nm,經固定之濾光鏡測出實際之濃度值。 |
| 10.5. |
1.4.Discriminator ( 血球信號鑑別器 )之說明 |
| |
當血球經過電極孔時,儀器則檢測出其電子脈衝,而將此每一佃脈衝之高度大小,依其比率可求出其血球之體積。 |
| 10.5. |
2.Sysmex F-800 血液學半自動分析儀之操作步驟 |
| |
| 1. |
將 Autodilutor AD 260 的選擇開關放在 WBC 的位置,吸管用面紙 ( 或紗布 ) 擦拭乾淨。 |
| 2. |
全血充分混合均勻後,放在吸管下,按 [Start] 使其吸取 20ul 血液。 |
| 3. |
以面紙拭淨管外血跡。 |
| 4. |
取一稀釋杯放在吸管下,使其沿杯壁放下 10ml 的稀釋液 (A) ( 稀釋 500 × )。 |
| 5. |
再將稀釋液 (A) 放在吸管下選擇開關放在 RBC 的位置,按 [Start] 使其吸取 100ul 的稀釋液。 |
| 6. |
以面紙拭淨管壁。 |
| 7. |
另取一稀釋杯放在吸管下,使其沿杯壁放下 10ml 的稀釋液 (B)( 再稀釋 100 × 即稀釋 50,000 × )。 |
| 8. |
將稀釋液 (A) 加 3 滴 Quicklyser,充分混合均勻 30 秒後,使完全破壞 RBC。 |
| 9. |
稀釋液 (A) 及 (B) 分別放在 WBC 及 RBC 電極檢檯。 |
| 10. |
接 [Count] ,約 20 秒即顯示 Data。(WBC、RBC、Hb、Hct、MCV、MCH、MCHC、 PLT)。 |
| 11. |
關機前,按 [Clean] 直至藍色清潔液流入廢水筒為止,再按 [Power off]。 |
|
| |
|
| 10.6. |
血球沈降速度的測定 |
| 10.6. |
1.原理 |
| |
於含血液的試管內加入抗凝劑,然後將試管垂直放置,經一段時間後,紅血球由血漿中而沈降下來,由沈降的距離計算出血球沈降速度。 |
| 10.6. |
2.方法 |
| |
血球沈降速度的測定有多種,由於便於血容比測定,最近很多試驗室均採用溫氏法 (Wintrobe's method)
| 1. |
器具
| (1) |
Wintrobe 管長 11㎝,內徑 2.5㎜,下端熔閉之 ( 有 0~10 之刻度於二側 )。 |
| (2) |
Wintrobe 吸管 ( 可用長 12㎝ 之 16-18G 注射針或公貓的導尿管 2ml 之注射筒代替。) |
|
| 2. |
步驟:
| (1) |
充份混合抗凝血液 ( 此時之抗凝劑只能用 EDTA Heller 和 Paul 兩氏的雙重草酸鹽或肝素之乾燥粉末或結晶 ) |
| (2) |
以 Wintrobe 吸管吸取檢查血液約 1c.c. ( 不可含氣泡 ),迅速的將吸管端插入Wintrobe 管底瑞,一方面壓出血液,一方面將往上抽高,( 應將吸管端保持於血液下面,則可預防發生氣泡 ) 裝至 Wintrobe 管 0 的記號處。 |
| (3) |
立刻將上述之 Wintrobe 管放置於管架,開始計時,馬血則記錄 20 分鐘時的血球沈降處。犬貓及豬則記錄一小時之結果,以幾 ㎜/20 或 60 等記錄後與下表求正負值報告之。 |
|
|
| 10.6. |
3.判定 |
| |
Shalm 曾報告血液與血沈的關係:
( 備註:貓血可利用犬者,如其差異在 ±10 上時有意義 )
|
血容比
|
馬 20 分時之血沈
|
犬 1 小時之血沈
|
|
10
|
86±1㎜
|
79㎜
|
|
15
|
80±1
|
64
|
|
20
|
70±2
|
49
|
|
25
|
60±3
|
36
|
|
30
|
47±5
|
26
|
|
35
|
28±15
|
16
|
|
40
|
11±8
|
10
|
|
45
|
2.5±1
|
5
|
|
50
|
0
|
0
|
|
| |
|
| 10.7. |
紅血球的指教 |
| 10.7. |
1.色素指數 (CI):即檢查的血液平均含血紅素與常血液比較 Color index |
| |
|
正常的設作 "1" 來比
|
設某情形下 HB=14gm﹪
|
|
HB
CI=----------=1
R × 3.0
|
14
則 CI=------------- =0.78
6 × 3.0
|
|
| 10.7. |
2.容積指數:(V.I) 查血球平均容積與正常血球比較,Volume index |
| |
| Ht |
|
45 |
|
|
| -------- |
= |
-------- |
= |
9 |
| R |
|
5 |
|
|
|
| |
|
Ht |
|
|
| V.I |
= |
-------- |
= |
1 |
| |
|
R × 9 |
|
|
|
判定:Normal cyte V.I=0.9-1.1
Secondary anemia microcytic V.I<1
Macrocytic V.I>1 |
| 10.7. |
3.飽和指數 (S.I):查血球內平均血紅素濃度與正常血球比較。 |
| |
Saturation index
設正常質為 "1"
| |
|
HB |
|
16 |
| S.I |
= |
-------- |
= |
-------- |
| |
|
Ht |
|
45 |
|
|
判定:正常情形 S.I=0.9-1.1 若 S.I=1.1 以上則為過飽和。
| HB × 3 |
|
CI |
|
|
| --------- |
= |
-------- |
= |
1 |
| Ht |
|
VI |
|
|
|
|
|
| 10.7. |
4.平均血球血色素量 Mean corpuscular hemoglobin (MCH) 表示每一個紅血球所含的平均血紅素量,以絕對值表示單位為 "r" (1rr=10-12gn)
HB (gm/dl)
MCH=--------------------- ×10
R(million)
狗的 MCH=30rr |
| 10.7. |
5.平均血球血色素濃度 Meau hemoglobin concentration (MCHC) 表示每一個紅血球所含平均血紅素濃度以百分比表示
HB
MCHC (%)=--- × 100
Ht
|
馬
|
32~38 |
牛
|
31~36 |
綿羊
|
33~34 |
|
山羊
|
35~45 |
豬
|
28~32 |
犬
|
30~35 |
|
貓
|
23~33 |
兔
|
31~35 |
雞
|
29 |
|
火雞
|
29 |
|
|
|
|
|
| 10.8. |
血液 ( 血漿、血清 ) 之比重測定 |
| |
全血的比重與紅血球有關,而血漿、血清之比重則與血漿蛋白有關,測定血液 ( 血漿、血清 ) 之比重有幾種,現以硫酸銅法簡述於下:
其法係以硫酸銅配製成一組比重不同之溶液,各盛於加塞後能密不漏氣大小形狀相同之小瓶中,每瓶內硫酸銅溶液之比重遞次相差 0.002
測定全血或血漿之比重時可以滴管吸取全血或血漿,於比重相當之硫酸銅液 1㎝ 上之高處滴入一滴,血或血漿進入硫酸銅後即於其表面形成一層蛋白銅 (Copper proteinate) 之薄膜。若硫酸銅血液之比重與該血滴或血漿之比重相同,則血滴或血漿即懸浮於硫酸銅液內。在數秒鐘內既不上升亦不下降,因已知硫酸銅之比重,故由是方知該血滴或血漿之比重。 |
| 10.9. |
紅血球脆性抵抗測定 |
| |
紅血球脆性測定用於貧血的分類,因為血球脆性在溶血性黃膽時減弱,而鬱滯性黃膽或出血後所生紅血球脆性增加,其方法為:
| (1) |
以 1% 之食鹽水做試藥。 |
| (2) |
取 10 支血清學應用小試管配列於試管架上,給予 15、14、13.12,至 6 之號碼。 |
| (3) |
取小滴管將試藥由 15 號試管開始放入 1.5ml,1.4ml,1.3ml,1.2ml,至 0.6ml,然後以蒸餾水將各試管各加至 2ml,即各試管成為由 0.75 至 0.3% 之具有 0.05% 等差距之食鹽水溶液系列,( 將試管號乘以 0.05 則得試管之食鹽濃度 %) |
| (4) |
採取靜脈血,立刻於每試管中各加入一滴鮮血,振盪置室溫 1 至 2 小時內判定。
因血清中多少有抑制溶血作用之物質,且其有個體差異,故有人曾擬以 3.8% 之檸檬酸鈉液以 9:1 防止凝固之靜脈血,用生理鹽水洗滌兩次,用沈澱之血球各加入一滴以求一致,溶血不明時可稍加遠心分離。 |
正常範圍如下:
|
畜別
|
馬
|
牛
|
綿羊
|
豬
|
犬
|
雞
|
|
最高阻力
NaCl ﹪
|
0.42
|
0.42
|
0.46
|
0.45
|
0.33
|
0.28
|
|
最低阻力
NaCl ﹪
|
0.57
|
0.59
|
0.69
|
0.74
|
0.46
|
0.44
|
|
| |
10.10.血液凝集:交叉配合試驗 |
| |
交叉配合試驗是在輸血前確定受血者和輸血者的血型是否相同,或受血者血漿內有無對輸血者的血球發生作用之凝集素,作配合試驗時所用標準血清,須從高度免疫的家畜取得之,如無標準血清可用受血者的血液替代做配合試驗。
其法為:
| (1) |
自受血者 (R),輸血者 (D) 分別採得靜脈血,一部分令其凝固,分離血清,一部分經抗凝後離心分離。 |
| (2) |
傾去血漿,加入生理鹽水,製成 5% 至 10% 懸液。 |
| (3) |
懸液置離心機內分離後,傾去上面液體,另加生理鹽水再分離,如此反覆洗滌三次至上面液體變清為止。 |
| (4) |
取二支直徑 7㎜之小試管,一支寫上 RS/DE,另一支寫上 DS/RE 之記號 (S:血清,E:紅血球懸液 ) |
| (5) |
試管 RE/DE 加入 RS3 滴 + DE1 滴 ( 主試管 )
試管 DS/RE 加入 DS3 滴 + RE1 滴 ( 副試管 ) |
| (6) |
兩支試管經振盪 1~2 分鐘後置室溫 20 分鐘。 |
| (7) |
置離心機內,每分鐘以 2,000 轉,轉動 1~2 分鐘。 |
| (8) |
輕動試管,觀察有無凝集溶血情形,已凝集的血球不再能勻和地混懸在液體中。 |
| (9) |
如主試驗 (+),則不適於輸血.兩管均 (-) 適合輸血,主試驗 (-) 而副試驗 (+) 時勉強可輸血,但應儘量避免。 |
|
| 10.11. |
血液凝固障礙試驗 |
| 10.11. |
1.凝固時間 |
| 10.11. |
1.1.方法: |
| |
| (Ⅰ) |
試管法: |
| |
取潔淨乾燥 8 × 70㎜ 之試管三隻,置於試管架上。用生理水沖洗後以潔淨乾燥之注射針由靜脈取血 5c.c.,記錄血液流進注射器之時間,於每試管內注血 1.5c.c.,1 分鐘後,使第一試管傾斜,檢查其內的血液是否已凝固,以後每隔 15~30 秒鐘傾斜試管一次,直至倒轉試管血液亦不流出為止。然後第二試管傾斜,記錄血液自靜脈管流入注射器至生成之血凝塊不至自試管溢出所需之時間,最後以第三試管校正所測得的數字。
此法在取血時,如注射針未能立即進入靜脈管換一針,重行取血,如室溫不在 65-90°F (18.3℃~32.2℃) 之間,應將試管置於 75°F (23.9℃) 之水內,試管口徑底為 8㎜,管徑愈大,則凝固時間愈長。 |
| (Ⅱ) |
毛細管法: |
| |
用潔淨乾燥內徑為 1㎜,長為 15㎝ 毛細玻管,將玻管置於穿刺部之血滴上血液即因毛細管作用而充滿毛細玻管,以後每隔 30 秒鐘斷此毛細管一小段,至纖維蛋白絲能在毛細玻管兩斷端引長 5㎜ 為止。 |
| (Ⅲ) |
玻片法: |
| |
係以數滴血液 ( 直徑約 4-5㎜ 之圓形血滴 ) 置於潔淨載玻片上,以針隔 30 秒鐘通過血清 1 次,至有纖維蛋白絲沾連於針頭上時為止。如氣候乾燥,為防血滴的水分蒸發,可將載玻片面向下擱置於盛有熱水之玻片上。 |
|
| 10.11. |
1.2.正常值: |
| |
| (1)試管法 |
(2)毛細管法 |
(3)玻片法 |
| 馬 4~15分鐘 |
馬 3~15分鐘 |
狗 3 分鐘 |
| 牛 4~15分鐘 |
牛 3~15分鐘 |
|
| 羊 4~8分鐘 |
羊 2.5 (1~6)分鐘 |
|
| 豬 6.2分鐘 |
山羊 2.5~11.5分鐘 |
|
| 狗 3~13分鐘 |
豬 2.5~4分鐘 |
|
| |
狗 3~4分鐘 |
|
|
| |
|
| 10.12. |
血液化學 |
| |
請參閱第十六章臨床化學檢查法 |
| |
|
| 10.13. |
血液正常值之範圍 |
| |
NORMAL BLOOD VALUES
EQUINE |
| Author Archer (5) |
No
|
Age Breed T.B. |
Brythrocytes
106 |
Hemoglobin
gm/100ml |
Hematocrit
% |
Leukocytes
103 |
Neut.
Segs. % |
Neut.
Bands% |
Lympho-cytes% |
Mono-cytes% |
Eosino-Phils% |
Baso
Phils% |
| |
38 |
Birth-6 mo. |
10.2
(7-13.1) |
14.1
(10.5-19.2) |
41.6
(31-52) |
8.36
(4.5-12.95) |
|
|
|
|
|
|
| |
36 |
2yr. |
9.5
(7.3-10.8) |
14.9
(11.8-17.8) |
40.7
(34.5-46) |
9.33
(6.22-13.4) |
|
|
|
|
|
|
| |
34 |
Geldings |
9.4
(7.5-11.4) |
15.0
(11.0-17.8) |
42
(33.5-56) |
7.04
(4.74-11.5) |
|
|
|
|
|
|
| |
24 |
Mares |
8.0
(6.23-9.95) |
14.5
(10.7-18.3) |
40.3
(30-57) |
8.45
(5.05-12.0) |
|
|
|
|
|
|
| |
132 |
Over-all |
9.45
(6.23-13.1) |
14.7
(10.5-19.2) |
41.2
(30-57) |
8.42
(4.5-13.4) |
|
|
|
|
|
|
| Berrier(8) |
|
|
6.94 |
12.5 |
30-44 |
10-11 |
60-70 |
|
38 |
4 |
4 |
1 |
| Brenon(9) |
359 |
Adult
T.B. |
6.90
(4.50-9.63) |
14.0
(9.7-18) |
43
(30-58) |
|
|
|
|
|
|
|
| Coffin(13) |
|
Draft |
6.5-9.4 |
9.0-14 |
30-44 |
5-11 |
56
(50-65) |
|
30
(20-40) |
8
(2-12) |
4
(1-5) |
0.5
(0-1) |
| |
|
T.B. |
8.0-13 |
11-17 |
35-58 |
8-15 |
45-60 |
|
46
(35-60) |
6
(1-8) |
|
|
| Hansen |
|
T.B. |
|
|
|
|
|
|
|
|
|
|
(20.21,
22,23) |
70 |
Weanilings |
11.24
(9-12.81) |
11.97
(10.2-13.7) |
36.8
(30.2-42) |
13.64
(7.62-18.57) |
45
(20-73) |
|
49.7
(22-79) |
2.72
(.5-8) |
2.3
(.5-7) |
0.1
(0-1) |
| |
36 |
Stallions |
10.81
(8.33-13.3) |
14.69
(12-18.3) |
46.78
(38-58.5) |
8.27
(5.05-11.9) |
50.75
(35-65) |
|
43.75
(30-57) |
2
(.5-7) |
4
(.5-7) |
0.5
(0-2) |
| |
65 |
Mares in
foal |
10.52
(8.6-12.5) |
14.89
(12.5-16.5) |
45.10
(38-51) |
10.01
(6.85-13.5) |
49.19
(30-66) |
|
43.79
(24-65) |
2.68
(.5-6) |
3.65
(.5-9) |
0.66
(0-3) |
| |
70 |
Barren mares |
9.94
(8.01-11.79) |
13.83
(11.9-16.0) |
43.05
(35-49) |
10.37
(7.10-14.1) |
48.2
(25-63) |
|
44.5
(29-71) |
1.7
(.5-6) |
4.6
(.5-11) |
0.5
(.5-2) |
| Holman(25) |
|
|
7.0 |
10.0 |
28 |
9.0 |
58 |
|
29 |
5 |
7 |
|
Schalm
(338.39) |
|
cold-
blooded |
7.5
(5.5-9.5) |
11.5
(8-14) |
35
(24-44) |
8.5
(6-12) |
54
(35-75) |
0.5
(0-2) |
35
(15-50) |
5
(2-10) |
5
(2-12) |
0.5
(0-3) |
| |
|
Hot-
blooded |
9.8
(7-13.0) |
13.4
(10-18) |
42
(32-55) |
10
(7-14) |
49
(30-65) |
0.5
(0-2) |
44
(25-70) |
2
(.5-7) |
4
(.5-11) |
0.5
(0-3) |
| Todd (41) |
28 |
T.B. foals |
11.77 |
122 |
36.54 |
13.12 |
53.26 |
|
42.16 |
2.37 |
21 |
0.07 |
NORMAL BLOOD VALUES
BOVINE |
| Author Archer |
No
|
Age Breed T.B. |
Brythrocytes
106 |
Hemoglobin
gm/100ml |
Hematocrit
% |
Leukocytes
103 |
Neut.
Segs. % |
Neut.
Bands% |
Lympho-cytes% |
Mono-cytes% |
Eosino-Phils% |
Baso
Phils% |
| |
|
|
|
11.5 |
40 |
5-12 |
|
|
|
|
|
|
| Albritton(3) |
|
|
|
(8.7-14.5) |
(33-47) |
|
|
|
|
|
|
|
| Benjamin(7) |
100 |
4-8 mo.
(Beef) |
8.26
(6.3-11.55) |
|
|
9.094
(4.9-19.5) |
26.55
(10-52) |
0.67
(0-4) |
61.79
(39-77) |
7.11
(1-18) |
3.9
(0-14) |
0 |
| Berrier(8) |
|
|
6-8 |
123 |
30-50 |
7-8 |
20-40 |
|
64 |
10 |
5 |
0-1 |
| Coffin(13) |
|
|
5.4-9 |
8-14.5 |
30-40 |
4.5-13 |
30
(15-55) |
|
52
(40-70) |
9
(3-15) |
8
(1-15) |
0.5
(0-1) |
| Ferguson(16)25 |
|
Adult
(Holst.) |
6.33 |
|
|
8.91 |
34.73 |
|
41.24 |
7.94 |
14.87 |
0.62 |
Greatores
(17) |
233 |
Birth
1 wk
2-4 mo.
4-6 mo.
1 yr |
7.4
7.5
8.1
7.8
7.5 |
|
|
8.70
9.70
9.30
|
45
32
37
21.7
27.7 |
|
50.8
62.5
68.6
68.2
67.0 |
2.8
3.7
3.4
5.7
2.2 |
1.1
1.5
1.9
4.9
3.0 |
|
| Holman(25) |
|
|
6.0 |
11.0 |
35 |
7.0 |
30 |
|
52 |
7 |
11 |
|
| Miller(31) |
|
56 Adult |
6.325 |
12.01 |
|
8.616 |
|
|
|
|
|
|
| 30 Younger |
6.08-13.8 |
|
|
8.24-13.80 |
|
|
|
|
|
|
| Schalm(36,39) |
|
|
7.0
(5-10) |
11.0
(8-14) |
35
(24-48) |
8
(4-12) |
28
(15-45) |
0.5
(0-2) |
58
(45-75) |
4
(2-7) |
9
(2-20) |
0.5
(0-2) |
| Schalm(37) |
23 |
Adult
(Angus) |
9.76
(6.5-17.9) |
12
(10.38-14) |
40.6
(36-49) |
9.70
(5.05-20.1) |
26.9
(6-45) |
|
62.9
(44-85) |
4.6
(2-7) |
5
(0-19) |
0.6
(0-2) |
| |
26 |
Under 1 yr
(Hereford) |
|
11.83
(9.63-14.25) |
38.4
(31-47) |
7.50
(3.20-12.0) |
27.9
(8-48) |
|
57.6
(33-87) |
4.1
(2-8) |
9.4
2-30 |
0.6
0-2 |
| |
50 |
Adult
(Hereford) |
|
11.32
(9.5-13.5) |
37.5
(27-50) |
11.14
(5.75-17.8) |
23.7
(12-38) |
|
68
(12-80) |
3.2
(1-5) |
4.3
(1-10) |
0.6
(0-2) |
| |
13 |
Adult
(Holstein) |
8.78
(7.2-10.18) |
10.8
(9.25-13.25) |
38
(33-48) |
284
(4.75-12.7) |
32.5
(18-46) |
|
54.3
(36-71) |
5.7
(3-8) |
5.2
(3-7) |
0.6
(0-2) |
| |
58 |
Adult
(Jersey) |
8.26
(4.63-12.5) |
11.21
(7.75-14.0) |
37.3
(27-50) |
288
(3.55-17.4) |
24.7
(8-51) |
|
60
(33-85) |
4.6
(1-15) |
9.7
(0-32) |
0.9
(0-2) |
| |
23 |
Under 1 yr
(Jersey) |
11.2
(4.34-17.35) |
10.9
(8.45-13.13) |
32.5
(25-44) |
276
(5.15-10.55) |
18.3
(4-43) |
|
72.2
(45-84) |
7.6
(0-16) |
0.9
(0-3) |
0.3
(0-2) |
|
| |
NORMAL BLOOD VALUES
OVINE |
| Author |
NO |
Age.
Breed |
Erythr-ocytes 106 |
Hemoglo-bin gm.1 100ml. |
Hemato-crit % |
Leukocut-es 103 |
Neut. Segs % |
Neut. Bands % |
Lympho-eyts % |
Mono-cytec % |
Eosino-Phils % |
Baso Phils % |
| Albritton (3) |
|
|
12.6
(10-15.5) |
32
(22-40) |
4-10 |
|
|
|
|
|
|
|
| Becker (6) |
18 |
Mixed |
11.9 |
12.41 |
37.9 |
|
|
|
|
|
|
|
| Berrier (8) |
|
|
8-10 |
11.18 |
33-46 |
7-8 |
20-49 |
|
48 |
6 |
4 |
0-1 |
| Britton (10) |
134 |
Lambs |
|
12.2
(10-14) |
29.1
(28-34) |
|
|
|
|
|
|
|
| Coffin (13) |
|
|
8.5-13.5 |
9-14.5 |
83-46 |
4-12 |
40
(20-50) |
|
52
(40-70) |
4
(1-12) |
6
(0-15) |
0.2
(0-2) |
| |
190 |
Mixed |
10.97 |
9.94 |
32.8 |
7.62 |
|
|
|
|
|
|
| Holman (24) |
89 |
|
11.5
(6.2-15.5) |
12.4
(8.6-15.8) |
30.5
(22-39) |
9.2
(1.1-17.5) |
24
(11-47) |
|
67.3
(41-83) |
2.3
(0-13) |
4.2
(0-15) |
0.5
(0-3) |
| Schalm (3839) |
|
|
12
(8-16) |
12
(8-16) |
38
(24-50) |
9
(10-50) |
30
(10-50) |
0.5
(0-2) |
0.2
(40-75) |
2.5
(1-6) |
4.5 |
0.5
(0-35) |
NORMAL BLOOD VALUES
CAPRINE |
| Author |
NO |
Age.
Breed |
Erythr-ocytes 106 |
Hemoglo-bin gm.1 100ml. |
Hemato-crit % |
Leukocut-es 103 |
Neut. Segs % |
Neut. Bands % |
Lympho-eyts % |
Mono-cytec % |
Eosino-Phils % |
Baso Phils % |
| Albritton (3) |
|
|
|
10.6 |
34 |
5-14 |
|
|
|
|
|
|
| Berrier (8) |
|
|
13 |
10.90 |
30-40 |
8-9 |
20-40 |
|
48 |
5 |
1.5 |
0-1 |
| Coffin (13) |
|
|
12.5-22 |
9-14 |
28-40 |
5-13 |
36 |
|
58 |
2 |
3.5 |
0 |
| Duker (14) |
|
|
13.9 |
10.9 |
|
|
|
|
|
|
|
|
| Hoorans (25) |
|
|
12.6 |
11.5 |
27.7 |
7.7 |
50.3 |
|
43.7 |
3.6 |
2.3 |
|
| Schalm (38,39) |
|
|
15
(12-20) |
11
(8-14) |
35
(24-48) |
12
(6-16) |
36.5
(30-48) |
0.5
(0-2) |
55
(50-70) |
2.5
(1-4) |
5
(3-8) |
0.5
(0-2) |
|
| |
NORMAL BLOOD VALUES
PORCINE |
| Author |
NO |
Age.
Breed |
Erythr-ocytes 106 |
Hemoglo-bin gm.1 100ml. |
Hemato-crit % |
Leukocut-es 103 |
Neut. Segs % |
Neut. Bands % |
Lympho-eyts % |
Mono-cytec % |
Eosino-Phils % |
Baso Phils % |
| Berrier (8) |
|
|
7.44 |
12 |
32-47 |
15 |
41 |
|
47 |
8 |
2.5 |
0-1 |
| Calhoun (12) |
7 |
21-25 days |
5.1 |
12.1 |
|
10.193 |
31.7 |
7.9 |
47.7 |
8 |
1.4 |
1.4 |
| 11 |
32-36 days |
7.0 |
12.7 |
|
14.273 |
31.5 |
11.5 |
49.6 |
5.7 |
0.8 |
0.8 |
| 30 |
3mo. |
6.6 |
11.1 |
|
18.265 |
25.2 |
8.9 |
54.8 |
2.7 |
7.3 |
0.5 |
| 12 |
5mo. |
5.1 |
|
|
12.871 |
22.2 |
8.3 |
58.7 |
8.9 |
1.7 |
0.6 |
| Coffin (13) |
|
|
5-9 |
9-16.8 |
32-47 |
8.6-20 |
39
(30-50) |
|
52
(40-60) |
3
(1-10) |
4.5
(1-10) |
1
(0-4) |
| Holman (26) |
200 |
Birth |
5.722 |
12.36 |
|
12.7 |
68.41 |
|
29.64 |
1.26 |
0.45 |
0.23 |
| Luke (30) |
110 |
Adult |
|
|
|
19.866 |
32 |
|
65.4 |
|
1.6 |
|
| Scarborough (36) |
215 |
|
6.7 |
12-13.2 |
|
8-20 |
39 |
|
52.1 |
3.3 |
4.5 |
1.2 |
| Schalm (38,39) |
|
|
6.5
(5-8) |
13
(10-16) |
42
(32-50) |
16
(11-22) |
37
(28-47) |
1.0
(0-4) |
53
(39-52) |
5
(2-10) |
3.5
(0-11) |
0.5
(0-2) |
| Swenson (40) |
78 |
Birth |
5.02 |
10.93 |
32.65 |
8.43 |
|
|
|
|
|
|
| Wintrobe (43) |
300 |
Adult |
7.93 |
15.0 |
46.3 |
7-20 |
|
|
|
|
|
|
NORMAL BLOOD VALUES
CANINE |
| Author |
NO |
Age.
Breed |
Erythr-ocytes 106 |
Hemoglo-bin gm.1 100ml. |
Hemato-crit % |
Leukocut-es 103 |
Neut. Segs % |
Neut. Bands % |
Lympho-eyts % |
Mono-cytec % |
Eosino-Phils % |
Baso Phils % |
| Adler (2) |
110 |
2-8 mo. |
5.5 |
11.2 |
|
12.24 |
50.55 |
5.37 |
37.77 |
0.5 |
5.79 |
|
| Albritton (3) |
|
|
6.3
(4.5-8) |
14.8
(11-18) |
45.5
(38-53) |
12.00
(8-18) |
68
(62-80) |
|
21
(10-28) |
5.2
(3-9) |
5.1
(2-14) |
2.7
(0-2) |
| Allen (4) |
25 |
Adult |
5.94 |
14.6 |
48 |
12.432 |
57.37 |
|
39.75 |
.05 |
2.12 |
0.12 |
| Berrier (8) |
|
|
6-8.16 |
13 |
40.58 |
10.12 |
60-70 |
|
25 |
8 |
10 |
0-1 |
| Bruner (11) |
34 |
Adult |
6.45 |
13.56 |
44.28 |
14.18 |
|
|
|
|
|
|
| Coffin (13) |
|
|
6.4-8 |
12-17.8 |
40-55 |
11.8
(6-20) |
69
(60-75) |
|
20
(10-30) |
6
(2-12) |
5
(2-10) |
0.5
(0-2) |
| Ederstrom (15) |
158 |
1-3 days |
3.61 |
10.5 |
39.8 |
|
|
|
|
|
|
|
| Landsberg (28) |
95 |
3-4 mo. |
5.00 |
8.92 |
37.82 |
11.80 |
63.61 |
4.37 |
28.13 |
0.7 |
1.81 |
0.03 |
| Morris (32) |
35 |
2-8 mo. |
5.30 |
12.6 |
|
12.165 |
55.85 |
6.7 |
33.3 |
0.15 |
3.97 |
0 |
| 35 |
Adult |
|
6.2 |
15.1 |
11.467 |
65.27 |
6.56 |
21.7 |
0.67 |
5.43 |
0 |
| Mulligan (33) |
60 |
Adult |
6.79
(5.22-8.46) |
14.5
(11-18.8) |
|
13.15
(5.45-28.25) |
73.9
(54-91) |
4.3
(5-10) |
21.7
(4.5-37) |
1.7
(0-7) |
3
(0-13) |
0 |
| Mundhenk (34) |
100 |
Adult |
6.042 |
|
|
8.867 |
64.63 |
|
19.28 |
8.66 |
7.025 |
0.205 |
| Schalm (38,39) |
|
Adult |
6.8
(5.5-8.5) |
14.9
(12-18) |
45
(37-55) |
11
(6-18) |
70
(60-77) |
1
(0-3) |
20
(12-30) |
5
(3-10) |
4
(0-10) |
0 |
|
| |
NORMAL BLOOD VALUES
FELINE |
| Author |
NO |
Age.
Breed |
Erythr-ocytes 106 |
Hemoglo-bin gm.1 100ml. |
Hemato-crit % |
Leukocut-es 103 |
Neut. Segs % |
Neut. Bands % |
Lympho-eyts % |
Mono-cytec % |
Eosino-Phils % |
Baso Phils % |
| Ackart (1) |
20 |
Adult |
7.24
(4.6-9.7) |
11.22
(8.7-14.5) |
40-15
(28.5-47) |
15.0
(5.6-28.9) |
59
(35-79) |
|
32
(11-52) |
0.7
(0-4) |
8
(2-31) |
0.01
(0-0.4) |
| Albritton (3) |
|
|
8
(6.5-9.5) |
11.2
(7-15.5) |
40
(28-52) |
16.0
(9-24) |
59.5
(44-82) |
|
31
(15-44) |
4
(.5-7) |
5.4
(2-11) |
0.1
(0-0.5) |
| Berrier (8) |
|
|
7.23 |
10.5 |
30-35 |
12-15 |
60-70 |
|
20-45 |
0-5 |
6 |
0.2 |
| Coffin (13) |
|
|
6.2-10 |
8-13.8 |
34-46 |
8-35 |
57
(30-75) |
|
32
(20-40) |
6
(1-15) |
5
(2-10) |
0.1
(0-0.5) |
| Hammon (19) |
40 |
Adult |
|
|
|
17.8
(8.9-46.4) |
|
|
|
|
|
|
| Jennings (27) |
25 |
1-6 mo. |
6.9
(5.7-9) |
10.9
(9.4-12.8) |
32.6 |
13.0
(9.1-22) |
56.7
(40-72) |
|
32.9
(16-45) |
4.5
(1-7) |
5.2
(2-10) |
0.68
(0-2) |
| Landsberg (29) |
52 |
|
7.24 |
105 |
4.02 |
17.2 |
59.3 |
|
33 |
0.8 |
6.9 |
0 |
| Riser (35) |
5 |
8 wks. |
5.21
(4.3-6.2) |
|
|
11.725
(8-17.5) |
52.4
(40-71) |
|
34
(23-55) |
1.9
(0-5) |
6.6
(0-15) |
|
| |
20 |
Adult |
7.82
(6.17-9.8) |
|
|
15.954
(10-31.2) |
54.26
(26-87) |
|
38.68
(17-30) |
1.5
(0-4) |
5.4
(0.15) |
|
| Schalm (38,39) |
|
|
7.6
(5.5-10) |
12.0
(8-14) |
37
(24-45) |
17
(8-25) |
59
(35-75) |
0.5
(0-3) |
32
(2055) |
3
(1-4) |
5
(2-12) |
0 |
| Vaulont (42) |
20 |
Adult |
7.85 |
12.8 |
|
9.2-24 |
82-84 |
|
8-45 |
1-3 |
1-18 |
|
|
| |
|
| 10.14. |
結語 |
| |
血液學檢驗設備,檢驗儀器不斷翻新,檢驗方法層出不窮,使用各種檢驗方法時,都要熟悉各種檢驗方法的原理,操作步驟及可使用之限度,然後加以適當應用;不同檢驗方法間的關係,必要時也要加以瞭解,然後才能勝任各種檢驗,享受檢驗的好處。
然而各種檢驗的結果,都是各種臨床症狀的另一表徵,與臨床症狀息息相關,必須與臨床互相配合才會更加有意義。所以使用臨床病理檢查法時,若能時時刻刻與臨床互相配合,再加以判讀,相信一定能把各種檢查數據、檢查結果做最充份的利用及得到最大的助益。反之,若只憑臨床經驗,不做各種臨床病理檢查,或只一昧相信臨床病理檢驗結果,而不與臨床恰當配合,那就難免有時鬧笑話或發生錯誤了。 |
| |
|
| 10.15 |
參考資料 |
| |
| (1) |
獸醫實驗室診斷手冊。 |
| (2) |
獸醫實驗診斷學提要。 |
|

