第十二章 病理學檢查法
- 建立日期
- 96年01月10日
- 更新日期
- 96年01月10日
- 內容
12. 屍體解剖技術 屍體解剖為病理學檢查首要步驟,剖檢時應詳細記載病變、剖檢日期、地點、性別、年齡、死亡時間、死亡方法 ( 自然死亡或撲殺 ) 及病歷摘要等,皆應按剖檢順序逐一記錄之。
解剖記錄描述應客觀精確,避免直接用病理學名詞,要顧及大小、形狀、色澤、數目、硬度及位置等六個要點,病變於器官分佈情形要儘量利用解剖學之位置關係,並以局部、局限蔓延、瀰漫等用語敘述,必要時可以圖解補充之,解剖記錄必需真實易懂,讓人讀之有如親身剖解一般。12.1. 解剖步驟 12.1. 1.外景檢查:屍體外景檢查為死因診斷之重要依據,先檢查外部天然孔。 口、鼻、耳、眼、生殖器及體表等是否變色?是否有移位、挫傷亦或腫瘤生成等病變。幼齡動物應特別檢查臍部有無異狀。
注意死亡時間,需排除屍斑、屍僵等死後變化,以免與真正病變混淆,若呈腹部膨脹、直腸突出及發惡臭等病變,皆屬死後變化。
動物之營養狀況,如肌肉、脂肪組織發育情形,若為營養良好之屍體,可疑為急性死亡,營養不良且呈貧血病變者,多屬慢性疾病或寄生虫感染症。
天然孔外露之黏膜若呈灰白色多屬貧血,呈黃白色者多為黃疸症,點狀出血或斑狀出血者為敗血性傳染病或急性中毒等疾病。
天然孔若有凝固不全血液漏出,可疑為炭疽、或急性敗血症如豬之放線桿菌胸膜肺炎或豬萎縮性鼻炎等疾病。12.1. 2.剝皮 大動物牛等採右側臥位置,豬採左側臥位置,小動物如雞、狗等使其仰臥,沿腹正中線下刀,切開皮膚,上沿頸溝縱切頸部皮膚,至頸部末端橫切。
四肢在內側正中線切開皮膚,在球節作輪狀切線,剝開皮膚。
小動物不必剝皮,沿腹中線切開即可。
剝皮後應仔細檢查體表淋巴結。12.1. 3.1.皮下檢查 皮膚: 檢查時應注意色澤變化,是否角化不全或角化過度,皮下組織有無膠樣浸潤等病變。 出血: 皮膚出現斑點,多見於犬瘟熱、豬瘟、敗血性傳染病等,前項出血指壓不褪色,若是豬丹毒呈現之蕁痲疹型紫斑,則指壓會褪色需鑑別之。 潰瘍: 犬瘟熱皮膚病變若繼發二次感染疾病,常可見潰瘍灶。 痘瘡: 家禽患雞痘者、肉冠、肉垂、眼瞼、鼻孔周圍及無羽毛皮膚等處,初發生黃灰色結節,繼而形成痂皮。羊痘易發部位為頭部,但有時會發生於全身皮膚。豬痘亦可發於耳翼、腹部等皮膚。 肥大: 厚皮病 ( 象皮病 ) 多發現於放線菌症或絲狀虫感染症,患部皮膚呈肥厚硬結狀。疥癬虫為害部多現腫脹,表面粗糙,豬若繼發二次細菌感染疾病,如鏈球菌或葡萄球菌等感染者,可見皮膚油膩污穢。 12.1. 3.2.皮下組織 水腫: 皮下漿液浸潤者稱之。重症心臟病、腎臟病、長期慢性病等患畜,顏面、胸前及四肢等部多發。 氣腫: 皮下積有過量之空氣或氣體者,以手壓之呈捻髮音。如黑腿病、惡性水腫患畜多發。 出血: 如敗血症或急性中毒等病例 。 12.1. 1.3肌肉 觀察肌肉顏色是否有變性、壞死、出血及寄生虫寄生等。 變性: 急性熱性傳染病、中毒或營養缺乏症等,肌肉顏色會改變,如熱射病者其肌肉呈水煮樣肉般蒼白。 壞死或結節: 病毒性疾病、腫瘤或寄生蟲感染症等,如牛赤羽病有時可見四肢骨骼肌呈壞死等病灶,雞馬立克氏病腫瘤細胞若侵入肌肉則呈白色結節;寄生虫如住肉孢子虫、雞住血原虫性白冠病等,皆可見白色結節散發於肌肉。 12.1. 4.內景檢查 12.1. 1.1.腹腔檢查 經由詳細外景及皮下檢查後,剖開體腔再檢查內景。先由腸骨外角穿入刀刃,沿季肋骨緣切開至胸骨劍狀突起,再由腸骨外角切至恥骨縫,則腹腔即露出。( 要小心不可劃破胃壁或腸管 )
腹腔切開時應注意有無臭氣發生。
腹腔打開時,逐一檢查各臟器之相關位置,外觀與鄰接臟器之關係,同時觀察腹腔有無儲留液、異物或寄生虫。
依次將腹腔內臟器取出,洗滌後置於解剖臺上,詳細檢查外觀及硬度。外表檢查後再切開檢查斷面及黏膜面,胃及腸應以剪刀縱斷除去內容物,觀查其性狀、份量及有無臭氣等,再以水沖洗黏膜面觀察有無變化。反芻獸剖開腹腔後,切開大網膜露出胃部,在其兩端結紮後切斷移至腹腔外,十二指腸與肝臟及胰臟一起合併剔除,腎臟個別剔出。
馬剖開腹腔後,先取結腸盲腸,再將脾臟及大網膜一併剔除,次將十二指腸及胃一併移出。切斷門脈後,將肝臟與胰臟分離,並將附近韌帶切斷,最後摘除腎。
肉食獸將大網膜,脾臟合併取出,在直腸末端及與胰臟附著之小腸結紮,切斷取出,十二指腸與胃一起移出,取出肝臟,腎臟與輸尿管、膀胱及尿道一起移出。12.1. 1.2.胸腔檢查 大動物可將解剖刀插入第 5、6 肋骨間,上下延長切口,切斷肋間肌,再鋸斷肋骨上下兩端,肋骨斷離,即露出胸腔。
中、小動物於仰臥位置剖開,以解剖刀切斷左右肋軟骨關節處,將腹半側之肋骨至胸骨合併移出,胸腔因而露出。
剖開胸腔後,檢查臟器位置、大小及肋膜有無異狀。
切斷舌下之肌肉及韌帶,以一手握住舌體向前牽引,割除周圍附屬物,舌即與口腔分離,檢查舌肌肉橫紋顏色及排列有無異狀,白肌病患畜,常於舌部可見肌肉變性或壞死。
將舌、食道、喉頭、氣管、甲狀腺、肺及心臟一一取出,詳細檢查。詳細檢查頸部、咽頭部及顎下、頸下淋巴結,再檢查氣管及縱膈淋巴,最後將心臟與肺臟分離。12.1. 1.3.口腔檢查 剝皮後鋸斷左後下顎骨臼齒前方部位,沿上下臼齒間由口角至耳根切斷頰肌,將刀尖插入顎間切斷左側下顎間內面及其後緣諸肌肉。
將左側下顎骨移去,露出口腔。
有鼻疽病及豬萎縮性鼻炎之懷疑時,應檢查鼻中隔。12.1. 1.4.臚腔 ( 腦及脊髓 ) 檢查 (1) 切斷環頸椎,注意流出之腦脊髓液之顏色、體積及透明度。 (2) 鋸斷頭蓋骨前應先將鋸斷部位附近肌肉及結締組織除去。 (3) 在兩眼後緣,橫鋸成一橫斷線 ( 圖 1 之 1) 後,在鋸斷線後 2-3CM 處再鋸斷一橫斷線 ( 圖 1 之 II)。鋸斷時中央淺鋸,兩側深鋸以免損傷大腦。鋸斷顆狀突起上緣之聯線 ( 圖 1 之 III)。鋸斷時鋸齒應保持內傾 45°角。在前頭骨上以圖 1 之 I 線為正三角形底邊,再鋸斷 ( 如圖 1 之 IV) 鋸齒亦傾內約 45° 角。 (4) 最後沿正中線鋸斷頭蓋骨穹窿部。 (5) 以鑿及鎚鑿開鋸斷線內部份,即露出腦髓。 (6) 在腦髓側線切離硬腦膜,露出大小腦。 (7) 將左手插入骨與腦髓間,輕輕提起大腦前部,切斷嗅神經及視神經,再由腦前方徐徐上舉,順次切斷腦底部神經根,取出全部大腦、小腦、延腦及脊髓基始部。
腦取出後橫切,間距 1CM,檢查後再固定於 10% 中性福馬林內。尤其是懷疑病毒性腦炎之病例,務必每一部位之腦組織 ( 大腦、小腦、延腦及脊髓等 ) 皆各採一部份製作切片。(8) 中小動物之頸與軀幹不必切離,使其俯臥照前述要點取出。 (9) 檢查腦背面 ( 穹窿面 ) 血管軟腦膜狀態及有無異常附著物。 12.1. 1.5.骨盤腔檢查 (1) 大動物應先鋸斷恥骨縫際,除去附著於左側腸骨及坐骨之諸肌。 (2) 以鋸橫斷腸骨頸除去骨盤骨,切斷該部腹膜時,即露出骨盤腔。 (3) 雄性動物須切開陰莖部皮膚向後反轉,切開陰莖海綿體、坐骨海綿體韌帶及肌肉,再將肛門周圍皮膚切斷,然後將附著於骨盤臟器諸韌帶,後腸繫膜及血管等切斷取出直腸、膀胱、尿道及陰莖。切開陰囊取出睪丸、副睪丸及輸精管等。 (4) 雌性動物則將直腸、卵巢、輸卵管、子宮、膣、膀胱及尿道一併取出檢查之。 (5) 小動物鋸斷恥骨縫際,將兩手插入其斷端向左右分開,即可展開骨盤腔,然後將骨盤腔內臟一併取出。 12.2. 病材之採取及運送 臨床獸醫為求正確診斷,須將病材送至病理實驗室行組織切片檢查,採材需適當,若採材失當而保存失宜,往往無法正確診斷而找出病因。 12.2. 1.病材之選取因檢查之目的及疾病而異,故對於傳染病學、細菌學及病理學之基本常識及技術應熟練。 12.2. 2.採材時應十分仔細,初學者或遇無把握之病歷時,應做完全解剖,全身每一臟器組織皆需採取 ( 尤其是中樞神經不可疏忽 )。 12.2. 3.若需行微生物學檢查時,應採無菌操作,盛病材之容器也是無菌。採取後以冷藏方式速送達實驗室,若短期內無法輸送應置於低溫冷凍櫃中保存,以零下 80℃ 者最佳。 12.2. 4.病理病材固定於 10% 中性福馬林溶液中,病材以不超過 3CM 立方為原則,固定液需清澈透明,若病材中含大量血水會稀釋固定液之濃度,需更換新鮮固定液。 12.2. 5.盛病材之容器宜堅固,包裝亦應力求完善,以免破損。 12.2. 6.運送病材時應將檢查目的、病畜、病歷、剖檢記錄、採材年月日、方法及部位,使用之固定液種類等一併註明,供檢查人員參考。 12.3. 石蠟組織切片之製作 石蠟組織切片是最傳統也是應用最廣之組織切片法,其具有可切取很薄的切片 (3-5 μm) 、步驟快、可切取連續切片及組織塊可永久保存等特性。其步驟可概分為固定、修片、脫水、清洗、浸潤、包埋、切片及染色等八大項。圖 2 為典型之石蠟組織切片之製作流程。
12.3. 1. 固定 Fixation 良好的組織切片製備的基礎就是完整而適宜之固定,其特性如下: 防止屍體解剖後之變化 (Post morten changes),如腐敗及自溶。 儘可能保存細胞內容物一如生前一般。 使原來的軟組織硬化,而使得隨後的操作程序容易進行。
使原來半液體狀的細胞變成不可逆的半固體狀。 藉著生物染料及化學藥品染色,而幫助細胞構造的視覺觀察。 固定液之選擇,要根據組織被染色或保存之目的而定,組織塊以不超過 3cm 平方,0.4-0.5 cm 厚度為原則,而必須浸入至少 10 倍於其體積之固定液中。 12.3. 1.1. 固定原理: 固定液最顯著的作用是使組織之蛋白質產生變性,亦即使蛋白質變為不溶性而凝固,由於蛋白質之變性因而使組織得以抗拒在爾後的操作中所可能產生的損傷或變形。此外,組織塊也變的較容易為固定液所滲透,固定的好壞對以後之染色有極大之影響,有的固定液可能抑制或妨礙染料之作用,有的固定液則可兼具媒染劑 (Mordant) 之功用,因而加強染色的效果。 12.3. 1.2. 固定液之種類及特性 固定液之種類極多,往往視需固定之組織及採取之染色方法而定,茲列舉一些常用之常規固定液及其特性。 1. 10% 中性福馬林 10% 中性福馬林緩衝液 (10% Buffered neutral formalin) 是用的最廣泛的一種常規固定液,其不影響大部份的染色,使用範圍極廣。 10% 中性福馬林之配方 37-40% Formalin 100.0 ml Na2HPO4 , Sodium phosphate dibasic 6.5 g NaH2PO4 , Sodium phosphate monobasic 4.0 g 蒸餾水 Distilled water 900.0 ml 因為福馬林很容易氧化成 formic acid,因此為了要抵消 formic acid 的作用,福馬林液必須用 Sodium phosphate,Monobasic and dibasic 來緩衝。 用福馬林作固定液之優點是價格便宜、滲透力強、長時間浸潤不會使組織過硬、適合多種染色法,其亦可穿透與保存脂肪酸等,同時是最適於郵寄之固定液。缺點是其氣味極刺激,尤其對眼睛及鼻黏膜更甚。 2. 溴化氨福馬林溶液 (Formalin Ammonium Bromide Solution ; FAB) 37-40% Formalin 15 ml 溴化氨 Ammonium Bromide 2 g 蒸餾水 Distilled water 85 ml 此種固定液最適於作中樞神經系統之組織固定,特別是於腦切片有必要行鍍銀及鍍金染色時。 3. 福馬林-酒精-醋酸溶液 (Formalin-Alcohol-Acetic Acid Solution) 此溶液對於組織的迅速固定不錯,在蛋白質成分被完全固定之前防止醣類的溶解。Acetic acid 的作用在確定核蛋白的固定而使得到更好組織圖,大約 2mm 厚的組織片須要 4-6 小時完全固定。 4. Zenker's 固定液 (Zenker's fluid) 重鉻酸鉀 Potassium dichromate 25.0 gm 氯化汞 Mercuric chloride 60.0 gm 蒸餾水 Distilled water 1000.0 ml 冰醋酸 Acetic acid,glacial 50-100 ml 註:冰醋酸使用前再加入 以此固定液固定時組織不可過大 (長寬各為 2cm、厚度不可超過 2-4 mm),組織於 6-8 小時內即可固定完成,浸於此固定液過久,組織會變脆,固定後多餘的固定液必須利用自來水沖洗,沖洗的時間約需 1.5 個小時以上,若沖洗不完全時,殘留的固定液將會抑制或影響以後染色之效果,於固定及沖洗後可將組織保存於 70% 酒精中。 5. Helly's 固定液 (Helly's fluid) 重鉻酸鉀 Potassium dichromate 2.5 gm 氯化汞 Mercuric chloride 6.0 gm 蒸餾水 Distilled water 100.0 ml 高濃度福馬林 Full-strength formalin 5.0-10.0 ml (使用前再加入) 此固定液是骨髓及含血器官的最佳固定液。 6. Bouin's 固定液 (Bouin's fluid) 苦味酸之飽和溶液約 1.22%
(Picric acid,saturated aqueous solution,about 1.22%)
750 ml高濃度福馬林 (37-40% 甲醛 ) 250 ml 冰醋酸 (Acetic acid,glacial) 50 ml 此固定液亦可作特殊之研究 ( 如肝醣之固定 ),它的穿透作用及固定效果皆佳。其含有醋酸用於水產動物如蝦之固定,對軟化蝦體表之幾丁質有極佳之效果。但要注意於固定完成後,用 50% Alcohol 數次洗滌,搖動約 4-6 小時,以確定苦味酸之除去,再儲存於 70% 之酒精中。若不除去苦味酸,則染色會受影響,傷害正常之組織。 12.3. 2. 修片 (Trimming) 組織固定好後,要經過適當之修整,供切片之製作,修片時需注意病變區之部位,及臟器組織之特性便於後續之包埋工作,最好是剖解採材者自行修片,於切片判讀時方能迅速診斷疾病,修整之組織厚度以 2-4mm 為最佳,若厚度過薄組織塊於脫水過程中會捲曲,易造成切片製作時之困擾。組織塊修整好後置於脫水罐內經充份水洗後,再行脫水作用。 12.3. 3. 脫水 (Dehydration) 脫水作用乃是將已固定組織內之游離水份脫除,以使不能與水互溶之石蠟溶劑,得以取代。脫水作用之進行必須是逐漸的,因為組織假如一下子由水或水溶液中直接放入高濃度的酒精中,將因酒精與水之混合所產生之交流使組織內部組成發生扭曲變形。組織脫水所需之時間長短隨組織之大小及種類而定,尤其是組織塊之厚度,以不超過 5mm 為原則。組織病理實驗室最常用之脫水劑為酒精,因為其作用快、無毒而且可靠,由於酒精會促使組織發生皺縮或變形,所以不能將組織浸於高濃度的酒精中過久,,尤其是絕對酒精會使組織過硬。另外二氧二乙稀 (Dioxane)、丙酮 (Acetone) 及三乙醇磷酸鹽 (Triethyl phosphate) 等皆可作為脫水劑。 一般病理實驗室中所使用之脫水時間如下: 70% 酒精 1 小時 80% 酒精 1 小時 95% 酒精 1 小時 95% 酒精 1 小時 12.3. 4. 清洗 (Cleaning) 清洗作用之目的主要使組織一方面變的乾淨透明,一方面是能將酒精等脫水劑徹底清除,便於石蠟之浸潤。 一般常用之清潔劑包括二甲苯 (Xylene)、甲苯 (Toluene)、二氧二乙稀 (Dioxane)、香柏油 (Cedarwood oil)、氯仿 (Chloroform)及苯 (Benzene) 等。如果是用絕對酒精作脫水劑時,則於脫水後必須將組織再浸於 Xylene、Chloroform 或 Cedarwood oil 中加以清洗,以使不能與石蠟互溶的酒精完全脫除。如果用 Cedarwood oil 作清洗劑時,則於清洗後必須再將之浸於 Xylene 中使多餘之 Cedarwood oil 脫除。組織經 Xylene 清洗後可直接放入溶解之石蠟中,Xylene 與石蠟是互溶的。若使用 Dioxane 作脫水劑時,組織則無需再經清洗而可直接放入石蠟中,因為 Dioxane 除了同時兼具脫水及清洗之作用,而且還可與石蠟互溶,唯 Dioxane 對人體略有毒性,使用時應小心。 12.3. 5. 浸潤 (Infiltration) 組織在清洗完全後,為便利後續切片製作,必需使組織硬度增加,同時於切片切取過程中組織不致發生扭曲現象,浸潤作用即是以一種包埋劑,其可由液態轉為固態,當其呈液態時包埋劑可經由置換作用而進入組織間隙,然後再經結晶作用 ( 如石蠟 ),蒸發作用 (如 Celloidin),以及聚合作用等 ( 如 Epon)。 最常用來浸潤組織之包埋劑包括石蠟 (Paraffin) 及賽勞定 (Celloidin)。 石蠟於室溫下是一種固體,經加熱後可溶為液體而利於浸潤組織,用於浸潤的石蠟硬度最好與組織相接近,一般病理實驗室使用之石蠟可分為兩種,一為軟石蠟 (Soft paraffin),熔點為 45℃,另一種則是硬石蠟 (Hard paraffin),熔點為 56 至 62℃,以後者較為實用。石蠟之浸潤通常是分成 2-3 個交換步驟,因為唯有如此才可完全除去所殘留之清洗劑。在浸潤作用進行時需注意時間不可過久、溫度不可過高,因為時間過久或溫度過高都會使組織發生皺縮或過硬。 12.3. 6. 包埋 (Embedding) 欲製作好的組織切片,固定及包埋為首要,若固定不佳或包埋技術差,有如巧婦難為無米之炊般,絕不可能製出優良之組織切片。 組織在浸潤完全後,必須使其包被於可凝固之石蠟包埋劑中,以便組織切片之切取,組織之包埋劑可利用手摺的紙盒或船 ( 見圖 3-1)、塑膠包埋盒 ( 見圖 3-2)及 L 形金屬板來完成,現有更進步之組織自動包埋機 ( 見圖 4)、更方便於組織之包埋。下列為包埋之簡單操作程序。 12.3. 6.1. 組織充分浸潤後,由石蠟浴內取出脫水罐內裝有待切標本之小盒子,打開取出浸潤好之組織。 12.3. 6.2. 將溫熱之石蠟倒入包埋模內,約一半量 ( 倒時要慢以免氣泡產生 )。石蠟過熱時,組織與石蠟易分離,往往使得石蠟組織塊發生裂痕,染色時組織亦極易剝離。 12.3. 6.3. 將包埋模移於冰冷之盤內,再以溫熱之夾子將組織放入包埋模之底層 ( 注意切面要朝下 ),立即倒入石蠟至包埋模之頂部,待石蠟凝固後再將該含包埋模之盤子置於冰箱內。15-30 分鐘後即可修整石蠟塊待切。石蠟塊修成梯形者,不但便於伸展且有利於連續切片之製作。 12.3. 7. 切片之切取 切片機可分為迴轉式 (Rotary microtome) (圖 5) 及滑動式 (Sliding microtome) (圖 6) 切片機兩種,以迴轉式較常被使用、其操作也較簡單,初學者最好由比較容易之組織開始學 (如豬腦組織切片),小動物如老鼠等組織較硬,切片之難度較高。 12.3. 7.1. 切下之組織先置入冷水槽中使石蠟伸展 ( 注意有正反面,若方向錯誤較不易伸展 )。 12.3. 7.2. 以塗抹甘油蛋白之乾淨玻片或於溫水伸展槽中灑一層果膠,將平展之石蠟切片以上述之玻片撈取。 12.3. 7.3. 將撈取之石蠟薄片置入 60 ℃ 左右之溫水伸展槽中 ( 若玻片未經甘油蛋白處理,以果膠灑於溫水槽中,其會浮於水面待組織與其接觸後即有粘性,可附著於玻片上 ),水溫不可過熱且伸展時間也不可過久,否則石蠟組織會溶掉。 12.3. 7.4. 將乾淨玻片置入水中撈取完全伸展開之石蠟薄切片,使該切片置於玻片中央,直立數分鐘使水份流乾,將玻片端之水份吸乾並移於玻片溫熱器上 ( 圖 7) 乾燥,約一小時左右即可脫蠟染色。
12.3. 8. 染色 12.3. 8.1. 組織病理學上所應用染色作用之原理可概分為四大類: 化學結合作用:例如鐵染色所應用之普魯士藍反應。 物理性染色:利用染料於細胞組成上之溶解度,如脂肪染色。 吸附作用:常規的 H&E 染色就是利用此原理。 免疫化學染色:這種染色利用抗原及抗體之結合反應與酵素相互作用,可偵測出組織切片中特定之物質,為形態學診斷極佳之方法。 12.3. 8.2. 染色方法 因目的不同染色方法之種類繁多,可概分為 1.活體染色法 2.常規染色法 3.特殊染色法 。最常應用者為 常規染色法,主要作用在細胞核與細胞質之染色,如蘇木精與伊紅的染色法 (Hematoxylin and Eosin stain)。特殊染色法可染出組織中的細菌、黴菌、原虫或病毒抗原等,如抗酸性染色、PAS 染色及免過氧化酶染色等。 12.3. 8.2.1 常規蘇木精與伊紅染色法 (1) 蘇木精染色液之配製 ˙ Harris's Alum Hematoxylin 蘇木精 Hematoxylin 5.0 gm 絕對酒精 Absolute alcohol 50.0 ml 銨明礬或鉀石礬 Ammonium or Potassium alum 100.0 gm 蒸餾水 Distilled water 1000.0 ml 氧化汞 Mecrcuric oxide 2.5 gm 此為退行性染色,這種染色是先將組織作過度的染色 (Overstained),然後再部分退色。 ˙ Mayer's Hematoxylin 蘇木精 Hematoxylin 1.0 gm 蒸餾水 Distilled water 1000.0 ml 碘酸鈉 Sodium idoate 0.2 gm 銨明礬或鉀石礬 Ammonium or Potassium alum 50.0 gm 檸檬酸 Citric acid 1.0 gm 水合氯醛 Chloral hydrate 50.0 gm 此為進行性染色液,染料只要一染上組織即無法再脫除,故染色時間之控制極為重要。 (2) 伊紅染色液 (Eosin Staining Solution) 1% 伊紅酒精溶液 伊紅 Eosin Y,water and alcohol-soluble 10 gm 蒸餾水 Distilled water 50.0 ml 先將伊紅完全溶解蒸餾水中,然後再加入 95% 乙醇,95% ethyl alcohol 940 ml 染色步驟 12.3. 8.2.1.1. 脫蠟作用 (1) 將切片放入二甲苯中連續兩次,使石蠟完全脫除。 ( 每次約浸 2 分鐘 ) (2) 將切片置入絕對酒精二次,使二甲苯完全脫除。 ( 約 2 分鐘 ) (3) 將切片置入 95% 酒精中洗滌一至二次。 (4) 80% 酒精。 (5) 水洗 2-5 分鐘。 12.3. 8.2.1.2. 染色 先將 H 溶液 ( 一般為 15 分鐘左右,各實驗室配置之染料其染色時間皆異 ) 再染 E 溶液約 5 分鐘左右,旋即水洗。 12.3. 8.2.1.3. 脫水 由低濃度酒精依次至高濃度酒精,徐徐將組織中水分除去,可避免水泡之產生。 ( 如 70% 酒精- 80% 酒精- 95% 酒精- 100% 酒精) 12.3. 8.2.1.4. 清洗 ( 透明 ) 最常使用者為二甲苯,其可將酒精取代出,同時具將切片透明化之功用。 12.3. 8.2.1.5. 封蓋 以蓋玻片加封蓋劑,可保護玻片上之組織切片,同時便於顯微鏡之觀察,蓋玻片之大小隨組織切片的大小而定,但它必須大於組織切片。 方法: 將蓋玻片置於白色濾紙上,滴一滴封蓋劑於組織中央,然後以 45 度角徐徐將蓋玻片放下,以鑷子輕壓趕出氣泡,最後用沾有 Xylene 之紗布清除多餘之封蓋劑,將切片平放通風處或抽氣櫃內,待乾燥後即可鏡檢。。 12.3. 8.2.2. 特殊染色 病理實驗室除常規染色外,一些特殊染色也會應用到,然而特殊染色種類繁多,視實驗室型態不同或目地不同而有所差異,故列舉出一般組織病理診斷實驗室常用到的特殊染色法,主要是染出組織切片中之細菌、黴菌、原虫或病毒等病原,包括抗酸性染色 (Acid-Fast stain)、PAS 染色、鍍銀染色、Gram's 陽性及陰性染色法、及免疫染色法等五種。 12.3. 8.2.2.1. 抗酸性染色 (Acid-fast stain): Ziehl-Neelsen stain
染色液1. Carbol Fuchsin 溶液
使用前過濾之Phenol crystals. (melted) ………………………………………………… 2.5 ml Alcohol 100% ………………………………………………… 5.0 ml Basic fuchsin ………………………………………………… 0.5 gm Distilled water ………………………………………………… 50.0 gm 2. 1% Acid Alcohol 溶液
配成 acid alcohol 後待用,需染色時再稀釋成 1% Acid alcohol。Alcohol 70% ………………………………………………… 1000.0 ml HC1,Concentrated ………………………………………………… 10.0 ml 3. Methylene blue 溶液 Methylene blue ( 儲存液 )
Methylene blue ( 操作液 )Methylene blue ………………………………………………… 1.4 gm Alcohol,95% ………………………………………………… 100.0 ml Methylene blue ( 儲存液 ) ………………………………………………… 1.4 gm D. W ………………………………………………… 90.0 ml 染色步驟: 1. 選用陽性及陰性對照各一片,可察知染色是否成功。 2. 脫蠟。 3. Carbon fuchsin 溶液染色至少 30 分鐘,於 50℃ 溫水浴內染色效果更佳。 4. 充分水洗。 5. 用 acid alcohol 溶液脫色,速度要快,約數秒鐘即可。 6. 充分水洗,約 8 至 10 分鐘。 7. 浸入對比染色 methylene blue 染色溶液內,約 3 至 5 分鐘左右。 8. 充分水洗、然後浸於蒸餾水中。 9. 組織切片脫水、將切片浸於 70% 酒精- 80% 酒精- 95% 酒精- 無水酒精-最後置於二甲苯中使切片透明。 10. 封片鏡檢。 抗酸菌 紫紅色 紅血球 微黃、橙色 其他組織成分 淡藍色 12.3. 8.2.2. MC MANU'S 肝醣染色法 (PAS 染色法 ) 染色液 Normal hydrocholoric acid 溶液 Hydrocholoric acid, 83.5 ml D. W. 916.5 ml COLEMAN'S FEULGEN 溶液 將 1gm 之 Basic fuchsin 溶於 200ml 之熱 D.W 中,加熱至沸點,冷卻後加入 2gm Potassium metabiulfite,10ml normal HC1,漂白 24 小時後,加入 0.5gm 活性碳,搖動一分鐘後以粗濾紙反覆過濾,直至濾液澄清為止,存於冰箱中保存。 Schiff reagent 溶液 將 1.0gm 之 basic fuchsin 溶於 200ml 之熱 D.W 中,右熱至沸騰,冷卻至 50℃ 過濾,加入 20ml normal HC1,再冷卻後加入 1gm 無水酸性亞硫酸鈉,於避光處靜置 48 小時,直至溶液呈稻草色,存於冰箱中。 0.5% Periodic acid 溶液 Periodic acid 0.5 gm D. W 100 ml 0.2% Light green ( 儲存液 ) Light green 0.2 gm D. W 100.0 ml Glacial acetic acid 0.2 ml Light green ( 操作液 ) Light green ( 儲存液 ) 10.0 ml D. W 50.0 ml 染色步驟: (1) 脫蠟。 (2) 以 Periodic acid 溶液氧化 5 分鐘。 (3) 浸入 D.W。 (4) 以 Coleman's Feulgen 或 Schiff reagent solution 染色,5 分鐘。 (5) 水洗 10 分鐘使粉紅色展出。 (6) 用 light green 溶液作對比染色。 (7) 脫水。 (8) 封片。 結果: 真菌類 紅色 肝醣或原虫 玫瑰色至紫紅 細胞核 藍色 背景 淡綠色 12.3. 8.2.3. 免疫化學染色 此染色是以抗原抗體結合反應作為基礎之染色法,可找尋出組織中存有之病毒、細菌或特定抗原。 傳統上,於實驗室中廣泛被用來輔助診斷的螢光抗體法,常受到非特異性螢光干擾,螢光消退及需新鮮病材方能染色等因素限制。自 Taylar and Burns 等發表免疫過氧化  技術後,此法不但保有螢光抗體法之優點,亦可改正其缺點,故漸漸取代螢光抗體法之地位。本法適用經福馬林固定、石蠟包埋組織切片,對於任何抗原,包括細胞表面抗原,細胞內抗原及散佈於細胞組織中抗原,為輔助診斷及免疫學研究之最佳工具。近年來此法正急速進步中,目前在國外已成功的應用於許多病毒性疾病之診斷,已廣泛應用此法測定免疫球蛋白,腫瘤細胞,及特異抗體之鑑定等研究。禽病診斷方面已有應用於傳染性支氣管炎 (IB)、禽痘 (Fowl pox)、雞腎炎 (Avian nephritis virus)、傳染性喉頭氣管炎 (ILT)、雞里奧病毒 (Avian reovirus)、雞傳染性貧血因子 (CAA)、雞傳染性華氏囊病 (IBD) 等疾病診斷及致病機轉探討等文獻。
技術後,此法不但保有螢光抗體法之優點,亦可改正其缺點,故漸漸取代螢光抗體法之地位。本法適用經福馬林固定、石蠟包埋組織切片,對於任何抗原,包括細胞表面抗原,細胞內抗原及散佈於細胞組織中抗原,為輔助診斷及免疫學研究之最佳工具。近年來此法正急速進步中,目前在國外已成功的應用於許多病毒性疾病之診斷,已廣泛應用此法測定免疫球蛋白,腫瘤細胞,及特異抗體之鑑定等研究。禽病診斷方面已有應用於傳染性支氣管炎 (IB)、禽痘 (Fowl pox)、雞腎炎 (Avian nephritis virus)、傳染性喉頭氣管炎 (ILT)、雞里奧病毒 (Avian reovirus)、雞傳染性貧血因子 (CAA)、雞傳染性華氏囊病 (IBD) 等疾病診斷及致病機轉探討等文獻。國內費等先以福馬林固定雞脾臟細胞內染出免疫球蛋白。劉等自鴨病變組織中染出澱粉樣蛋白,李等應用此方法在家禽流行性感冒 A 型病毒之病理學研究,並成功自發病雞之內臟器管染出病毒抗原,王亦應用間接免疫過氧化  染色法偵測新城雞瘟病毒,嚴等亦應用此法於豬病毒性疾病之診斷,養豬科學研究所,亦以此法進行一系列豬病毒性疾病診斷之研究。
染色法偵測新城雞瘟病毒,嚴等亦應用此法於豬病毒性疾病之診斷,養豬科學研究所,亦以此法進行一系列豬病毒性疾病診斷之研究。1. 原理: 與螢光抗體法類似,不同點為接合免疫球蛋白 FC 部位之酵素,螢光抗體法接 FITC,免疫過氧化結合在免疫球蛋白上,與經過氧化標示之抗體和抗原作用形成抗原-抗體- Peroxidase 複合物, 再加入色原抽出物 (chromogenic substrate) 及過氧化氫 (Peroxidase),將色原抽出物-過氧化氫複合物氧化後即呈色,Peroxidase 於作用後並未消耗掉,當抗原-抗體- Peroxidase 附著後即沈澱,故不退色可永久保存。 2. 種類: 目前常被使用的方法有四種:直接法 (Direct method) ; 間接法 (indirect method) ; PAP method 及 Avidin-biotin method。 ˙ 直接法 (Direct method) 步驟較單純,快速,特異性高。敏感性則較低,一般用於測定免疫球蛋白。最常被用來鑑別的抗原有 IgG,IgA,IgM,C3 及 C4。 ˙ 間接法 (indirect method) 本法較直接法應用更廣,敏感性更高,第一種抗體對所檢查的抗原有特異性,再加上他種動物抗體結合過氧化  ( 但二次抗體只能與第一種抗體結合 ),再加上色原體抽出物及過氧化氫使呈色。
( 但二次抗體只能與第一種抗體結合 ),再加上色原體抽出物及過氧化氫使呈色。3. PAP Method 需三種試劑:初級,次級抗體及PAP複合物 (peroxidase 及 anti-peroxidase)。初級抗體具特異性,次級抗體能與初級抗體及PAP複合物作用,敏感性更高,尤其是經福馬林固定,石蠟包埋組織,一般抗原於固定過程易被破壞,但本法仍可清晰染出,但操作步驟較繁複且耗時長。最重要應用為腫瘤細胞特異抗原之鑑定及腫瘤分類,尤其是不易區別及已轉移之腫瘤。 4. Avidin-biotin method 與 PAP method 類似,需三種試劑:初級抗體對抗原具特異性,次級抗體標示 Biotin 能與初級抗體結合,第三種試劑是 peroxidase-biotin-avidin 之複合物,avidin 分子游離位可與二次抗體上的 biotin 結合。 本法於四種方法中最具敏感性,但操作步驟較繁複。 直接免疫過氧化酶染色法: 應用自行標示之渠草根過氧化酶特異血清,進行免疫染色,步驟與間接法類似,較簡單可節省水洗次數、抗體作用時間,減少切片之損傷。 1. 將切片通過 0.5% H2 O2 Menthol,10 分鐘,抑制內源性過氧化酶作用。 2. 0.1% 胰蛋白酶溶液,30 分鐘,37 ℃ 消化。 3. Tris-Saline buffer 洗數次。 4. 抗血清標示 HRPO,37 ℃,1hr。 5. Tris-Saline buffer 洗數次。 6. 於 3.3'-Diamino benzidine (DAB) 溶液中染色 10 分鐘。 7. Tris-Saline buffer 洗數次。 8. Hematoxyline 10 秒。 9. 水洗,脫水,透明,封片。 間接免疫過氧化酶染色法: 分別使用福馬林固定,石臘包埋組織切片進行染色。 1. 將切片通過 0.5% H2 O2 Menthol,10 分鐘,抑制內源性過氧化酶作用。 2. 0.1% 胰蛋白酶溶液,30 分鐘,37 ℃ 消化。 3. Tris-Saline buffer 洗數次。 4. 抗血清,37 ℃,1hr。 5. Tris-Saline buffer 洗數次。 6. 標示 HRPO 抗血清,37℃,1hr。
7. Tris-Saline buffer 洗數次。 8. 於 3.3'-Diamino benzidine (DAB) 溶液中染色 10 分鐘。 9. Tris-Saline buffer 洗數次。 10. Hematoxyline 10 秒。 11. 水洗,脫水,透明,封片。 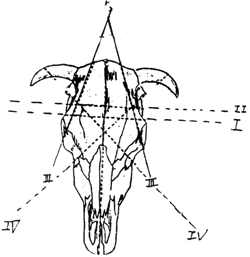
圖1. 腦之採取法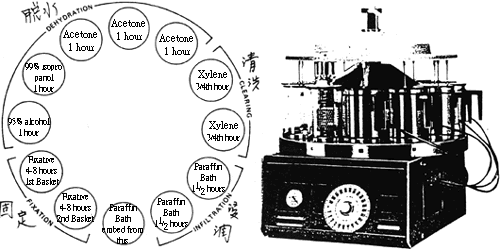
圖 2. 石臘組織切片,自動脫水機之操作程序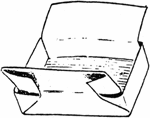
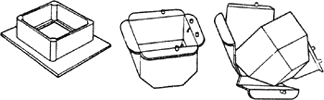
圖 3-1. 手摺之紙包埋 "盒" "船" 圖 3-2. 塑膠包埋盒 

圖 4. 自動包埋機 圖 5. 迴轉式切片機 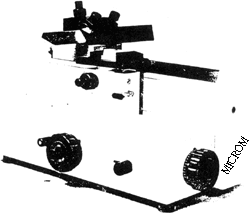
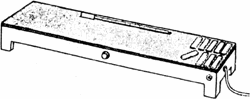
圖 6. 滑動式切片機 圖 7. 玻片加溫器
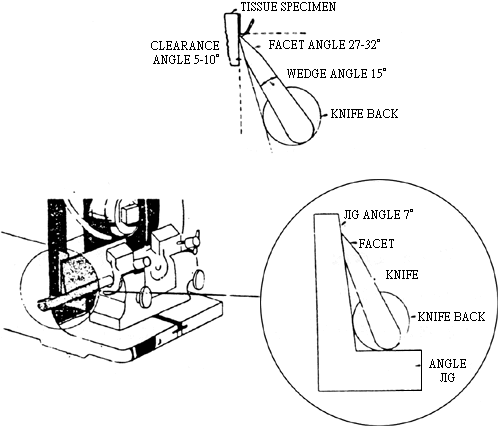
圖 8. 用角規來獲得正確的切片角度的圖解。重要參考文獻 1. 病理切片技術.張士章.大學圖書出社.1978 2. 組織病理技術手冊.杜啟安.黎明書店 1982. 3. 病理切片技術與組織學染色法,邱金賜.黎明書店.1978 4. 農業要覽.第十二輯.獸醫實驗技術.1979 5. Introduction to Electron Microscopy (3rd ed.) S. Wischnitzer. 1989. 6. Oxford textbook of pathology. Vol 2a. Oxford New York Tokyo Oxford University Press. James O'D. McGee.1992. 7. 李淑慧.1991. 雞工人感染家禽流行性感冒A型病毒之組織病理學研究.台灣大學獸醫學研究所碩士論文. 8. 費昌勇等.1984. 經福馬林固定之雞脾臟細胞內免疫球蛋白之免疫染鑑定法。中央研究院動物研究所集刊23卷2號,199-203頁。 9. 費昌勇等.1986. 經福馬林固定之牛脾臟細胞內免疫球蛋白之免疫染色法。中華民國獸醫學會雜誌.12:37-42. 10. 劉瑞生等.1984. 以酵素免疫法測定澱粉樣病之血清及病變組織中的球蛋白,中華民國獸醫學會雜誌.10:125-130. 11. 嚴家清、朱光寧、張錦山、劉福陰、謝文逸.1989. 豬病毒性疾病快速診斷系統之建立一冷凍切片雙重間接螢光抗體染色法。台糖公司畜產研究 76/77 年期研究試驗報告,P163-172。 12. 嚴家清、朱光寧、張錦山、劉福陰、謝文逸.1989. 應用 Avidin-Biotin-Peroxidase Complex (ABC) 技術於豬假性狂犬病診斷之研究。台糖公司畜產研究 77/78 年期研究試驗報告,P153-160. 13. 台灣養豬科學研究所八十年度研究計畫設計書.免疫化學染色法於豬隻疾病診斷之應用,P102-104. 14. Colette. J.etc.1990. The detection of turkey rhinotrachitis virus antigen in formalin fixed,paraffin embedded tissue using a streptavidin-biotin-immunoperoxidase method. avian patholog 401-407. 15. Hoop,R.K. & R.L. Reece.1991. The use of immunofluorescence and immunoper-oxidase staining in studying the pathogenesis of chicken anaemia agent in experimentally infected chickens. Avian pathology 20, 349-355. 16. Guy,J.S;Barnes,HJ;Smith, L.G. 1992 Rapid diagnosis of infectious laryngotracheitis using a monoclonal antibody based immunoperoxidase procedure. Avian pathology. 21 (1) 77-86. 17. McneillY.F. etc. 1991. Detection of chicken anaemia agent in chickens by immunofluorescence and immunoperoxidase staining. Avian pathology 20.1 25-132. 18. Narita M. etc. 1990. An immunohistological study on the nephritis in chicks experimentally produced with avian nephritis virus. Avian Pathology. 19. 497-509.
