第 十七 章 水產動物疾病檢查法
- 內容
17.1 水產動物疾病之病理學診斷 魚類各種疾病在外觀上所出現的癥狀,有許多是相同的,如無食慾,不活潑,顏色變化,鰭眾集在一起,以及腹部和眼睛的水腫等,在大多數病原,所引起的病例上都可以看見,並非各類疾病都有其特徵性。雖然有些疾病由某些特異性的徵候如明顯的興奮和疾速的泳動,或呼吸困難等就可以確定,但是大多數的病例仍須實驗室分析的配合以作更進一步的診斷。
實驗室分析的範圍是經常根據研究和魚類價值的問題而定。在多數不昂貴的魚類族群幾乎完全提供為祭品 (食用),很少有患病的魚完成臨床檢查的程度,但當疾病發生於有價值的魚類時,這種情形是不可以的,必須先作大體肉眼的外觀檢查以及新鮮魚鰓和皮膚壓片檢查。17.1. 1 屍體解剖技術 17.1. 1.1 樣品提送及處理程序 魚離水後體溫上升,而哺乳類動物死後體溫會下降而減慢質體分解速度。因而,魚的組織病材須儘放放入固定液內,以防止死後變化影響正確判讀。鰓之死後變化尤其快速,5 分鐘的延遲,就有鰓薄板上皮細胞腫脹 (Lamellar epitheial swelling) 及自基膜剝離的現象。生病的活魚為最佳病材,其次才為新鮮、冷藏 (不可冷凍) 的魚。故一般組織病理時,可使用 10% 緩衝福馬林 (Buffered formalin) 固定液。將病材罐子置於震盪機 (shaker) 上,浸泡組織 24 小時後,再修整組織塊。Bouin's 固定液適合眼睛、鰓、皮膚和小魚的固定使用,因其具有溶出礦物質的特性。切片操作時,可防止鱗和骨片造成組織切片的扭曲或刮痕,小魚也可全身切片。Bouin's 固定液的適當固定時間為 24-72 小時,其後取出組織塊,可保存於 70% 酒精,以待進一步處理。組織品供電子顯微鏡檢查用時,一般可使用 PH7.2 的 Cacodylate 緩衝液或磷酸鹽緩衝液所製成的 2-2.5% Glutaraldehyde (溶質度 Osmolarity 320 mOsm) 液固定,經以磷酸鹽緩衝液所製成的 1% 四氧化鋨 (Osmium tetroxide) 第二次固定,其後以階梯濃度的乙醇液脫水,最後包埋於樹脂中。
例行的組織病理處理操作和染色方法皆適用於魚病材的石蠟組織切片的製作,血液抹片和組織觸壓抹片 (Imprints) 以 Polychrome methylene blue 染色,可得到良好染色的抹片,供一般檢查使用。
例行檢查尚須注重自活、死魚上採取組織刮取物 (S-crapes)、塗抹片和壓擠片 (Squashes) 等進行檢查。皮膚、鰓的疾病如原蟲、寄生蟲感染,尤須進行本項檢驗,因一些原蟲於病理組織處理過程中可能脫落失掉而不易檢查得出來。17.1. 1.2 採血和麻醉 血液抹片雖通常可提供診斷線索,但在魚病診斷上,其用途比不上哺乳類動物。同樣地,過去魚病診斷也不常採血進行血清學和臨床化學的檢驗。近來由於分析儀器靈敏,血液學基本資料漸完整,血液學檢驗逐漸受到重視使用。採血方式以尾靜脈最常使用,心臟穿刺採血傷害較大,而背大動脈 (Dorsalaorta) 流輕口的背方,亦可做為諸如鮭類的採血部位。
麻醉方法,脊髓切斷 (自鰓蓋後緣) 方式會增加鰓簿板動脈瘤 (Aneurysms)。腦部敲擊方式比脊髓切斷法為差,會導致腦內出血及腦創傷。因而,水溶液麻醉 (Aqueous anesthesia) 方式最常被採用。最常用的麻醉劑為 Tricaine methane sulphonate (ms-222),其 0.1% 濃度數分鐘內可殺死大多數魚類。其他麻醉劑尚有 Benzocaine,Quinaldine,2-phenoxyethanol,二氧化碳等。17.1. 1.3 屍剖程序 適當的死剖方法有多種,但死體解部者應維持一種固定的方法,以容許自己可以進行魚與魚間的比較。4公司長以下的魚,可整集固定及處理,放入固定液前先切除鰓蓋,並切開腹腔,使固定液能適當地滲透入各臟器,如魚體稍大,可依下述過程進行屍體解剖: 1. 將魚右側向下放於檯面。避免使用衛生紙等防滑用品,此可免得病原或表皮被刮離開魚體。仔細檢查外表面的病變,做一些皮膚刮取物抹片供檢。 2. 自骨盤帶 (Pelvic girdle) 前緣切開腹腔,作一個開孔,稍加鈍剝,不要切到腸子或其他臟器。 3. 自前述開口,沿體腹部中線向前切開到下頸骨,向後切開至肛門。一些大的魚,骨盤帶堅硬,須用大的剪刀幫助剪開。 4. 切除整塊上腹壁肌肉,露出內臟。切除鰓蓋,注意偽鰓 (Pesudobranch),胸腺及甲狀腺。魚甲狀腺為瀰漫型,正常不易辨認。檢查魚鰓,製備鰓刮取抹片,並切一揌鰓置於波片上供檢。切下鰓弓 (Arches) 供組織病理用,應馬上放入固定液中。 5. 取下整副內臟及膀胱。如須要、移脾取腎供細菌培養。 6. 檢查心、肝、腎和胃腸道,並取部份樣品供檢。打開胃 (如魚有胃) 檢查有否食物。 7. 取出眼睛,自鰓蓋後緣切下魚類。 8. 將頭放在砧板上,切面朝下,以有力的刀子平行向下切掉顱骨,露出腦。 9. 如須要,取一塊或數塊皮膚及其下肌肉供檢。 文獻參考: 1. 許天來等編譯,魚病專輯 (1) -魚類系統組織病理學。 17.2 水產動物細菌性病原之診斷 陳清、柯浩然水產動物疾病病因調查與診斷是件繁雜的工作,因其能影響致病因素的因子頗多,諸如外在環境 (氣候變化、飼養管理、飼科品質等),內在環境 (水質優劣、水溫高低、飼養密度等),病原因素 (細菌性、病毒性、黴菌性、寄生蟲性、營養性等) 及魚體本身條件 (魚種、大小、健康狀況等) 這些因子都可以互相影響而有相加或相乘作用。所以除建立完整的實驗室病原鑑定技術外尚應做好現場調查記錄。如此,兩者資料彙整加以研判後方可作合理的診斷及最有效的防治。 17.2. 1 現場資料收集及建立(應把握徹底、迅速、確實原則) (一) 病歷建檔: 1. 病歷號碼應以數字或英文字母順序統一規格編號,所有樣本、資料等都要和病歷號碼相同,以便日後辨別及查詢。 2. 養殖戶姓名、電話號碼、地址及養殖面積都應詳加記錄。 3. 魚類病情發生時間、品種、大小、死亡順序等對診斷有幫助,而一般養殖戶送檢病材或申請檢驗時都會疏忽病發時間或將發病時間延後。如為混養魚池則應詳加詢問魚類品種、先後死亡順序及病發後有無治療情事,此應包括藥劑名稱、劑量、方法、投藥後情形。 4. 魚類死亡程度、特徵性的死亡率及環境因素可協助縮小發生的可能原因範圍,有助日後判讀指針。相關資料見表 1。 5. 現場魚類行為變化,先用一般性估計及描述不同大小品種的魚類病情有利詮釋其他環境及可能病因,見表 2、3、4、5。 6. 水質檢測應馬上檢驗,尤其是溶氧、PH值、道電度、顏色、溫度等,如在調查時仍有繼續死亡則應各在清晨、中午、晚上檢查一次水質,任何一種水質檢驗數據都和病情及原因有關。至於檢驗順序及採樣事項見表 6、7、8、9、10、11。 (二) 背景訪視:
在發病區完成調查檢驗後,應拜訪附近地區養殖戶情形,調查疫情分布及環境變化等,如有需要採樣應經主人同意後實施。背景訪視不可延遲病材送至實驗室時機。(三) 追蹤調查:有些病例仍要繼續於發病處追蹤調查,其原因如下:
有些病例仍要繼續於發病處追蹤調查,其原因如下:1. 再採樣作確實診斷。 2. 發現其它新資料,使檢驗者瞭解並確實致死的其他因素。 17.2. 2 檢查發病或瀕死的魚 (一) 肉眼外部觀察:
外觀不正常的外貌,必需注意,無論有無特異性的變化均應詳加記錄。外部症狀與可能病因摘要見表 12~22。(二) 肉眼內部觀察。
內眼所觀內部器官之顯現如腹腔、消化道需加以注意外觀症狀,如需要樣本內容物應延遲廢棄,保存於冷凍或冷藏處直至完全檢驗完畢。內臟器官之臨床病灶及病理條件下所產生的自然狀態病發間相互關係見表 23~28。17.2. 3 魚體組織行組織病理學檢查 一般組織學上的程序都是例行工作,在細菌學上其組織病理切片應行革蘭氏染色法才可與分離的細菌相互對照,增加診斷的準確率。鏡檢下可確知基礎的染色反應及病原形態。細菌形態及染色結果表29。 17.2. 4 組織之細菌性檢查: (一) 病材取樣除傷害的組織分離培養外,腎(前腎、後腎)、脾是硬骨魚類之保菌器官,故不可遺漏。 (二) 病材之採取及其輸送 (Specimen collection and their transportation) 1. 採材器具、輸送箱應經消毒:不污染病材,不使所含之細菌增殖或死滅,是一件非常重要之事情,且在可能之情況下,儘速將病材輸送至實驗室。 2. 病材之選採:應留意其代表性與價值性,且應在適當時期採取,採取病材之量要合適,不可太少亦無需採集過量。 (三) 培量基與病原之分離 (Media and pathogenic organisms isolation)
依據流行病學之觀察臨床病變,及解剖變狀,將可疑病材帶回實驗室後,即刻以合適之培養基作分離培養,原則上以使用二種以上培養基,以防因細菌之受限制而未發育致誤導。必要時並以液體增菌培養以利病原之分離。培養可分為需氧培養及厭氧培養二種方式同時進行,以利病原菌之分離。分離魚類病原細菌之培養基見表 30~33。其PH值應注意調整。(四) 分離菌之鑑定 (Identification of isolates)
由病材分離之細菌,可依培養外觀所見,形態學檢查,生化學特性試驗,血清學檢查,及動物接種病原性之鑑定等加以綜合判定,摘要述之如下:1. 培養外觀所見: a. 在固體平板培養基表面菌落:從外形、大小、有無隆起,構造、表面、邊緣、有無顏色、透明度、硬度以及有無臭味,加以詳細記錄。 b. 穿刺培養:發育之有無、程度、狀態、線狀或樹材狀、表面發育之有無,液化之有無、顏色有無變化、有無黑變 (硫化氫) 等加以觀察記錄。 c. 液體培養:發育之程度、混濁度、有無沈澱、表面發育、有無產生瓦斯,指示劑有無變化,顏色臭味等。 d. 血液瓊脂平板培養基:觀察有無溶血形象及何種型態之溶血。 2. 形態學之檢查: a. 可以用 Gram 氏染色法,亦可用簡單之 3% KOH 法先鑑定是陽性細菌或陰性細菌。 b. 經染色後以油鏡檢查其形狀、菌軸、大小、排列形態、棒狀、絲狀葡萄狀或紡錘狀等。 c. 用培養法 (SIM培養基) 或懸滴法 (Hanging drop method):檢查其有無運動性。 d. 可用鞭毛染色法及電子顯微鏡檢查法,以確定其有無鞭毛 (Flagella) 及線毛 (pili) 與其形狀。 e. 用芽胞染色法:檢查有無芽胞及其位置等。 f. 其他特別染色法如莢膜、異染小體等之檢查。 3. 生化特性之檢查:
分離所得之細菌,可依傳統方法,逐項鑑定其生化特性,亦可使用多項目簡便試劑一次做完多種要檢項目 (如 API20E 或 Rapid ID32E 等) 再做其他補助檢查,如此可節省很多時間,見表 34、35、36及圖1、2、3、4、5。4. 血清學檢查
經分離純化所得之細菌,可做成凝應反應抗原,沈降反應抗原,及應用補體結合反應等方法,由已知之免疫血清來測定未知之抗原,因其具有特異性,迅速性,因此應用價值很高,一般在菌種之鑑定及型別之區分廣被採用。(五) 動物接種試驗 (Inoculation in experimental animals)
由分離所得之細菌,液體培養所得之菌液或固體培養作成之細菌懸液,以小白鼠、天竺鼠、家兔等實驗動物作接種試驗,確認其有無致病性與程度,必要時亦可使用宿主動物如魚種做試驗,瞭解其病原性程度及各種病變重現之情形,供為確診鑑定之依據。17.2. 5 魚類細菌性疾病之列表如下: (請看下頁) 

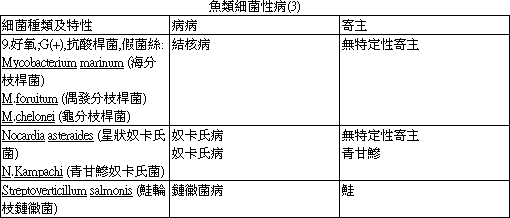
 表 2- 表 5
表 2- 表 5

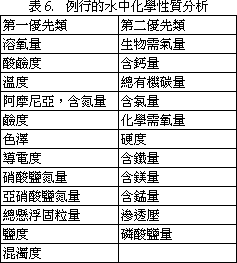
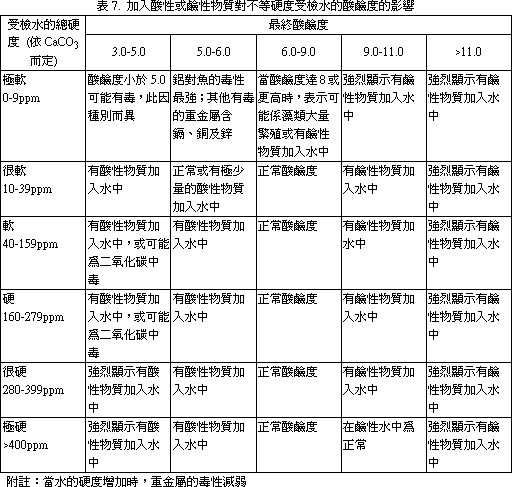

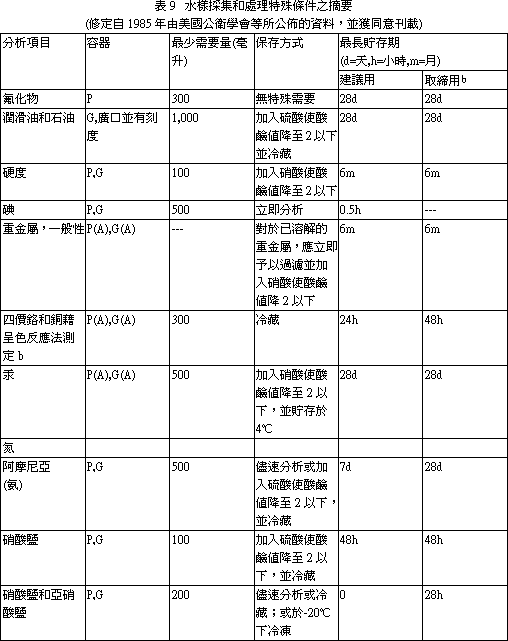
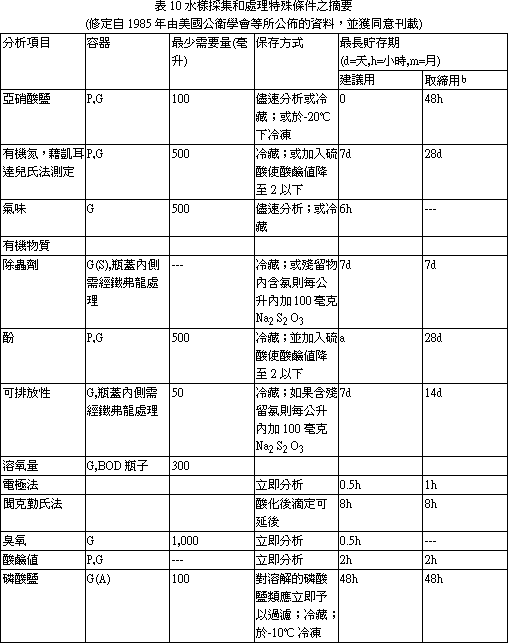
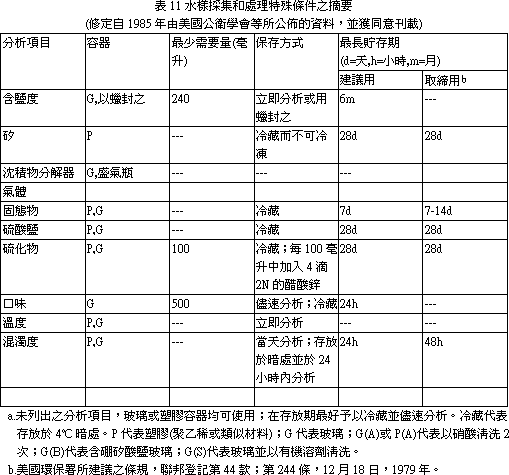


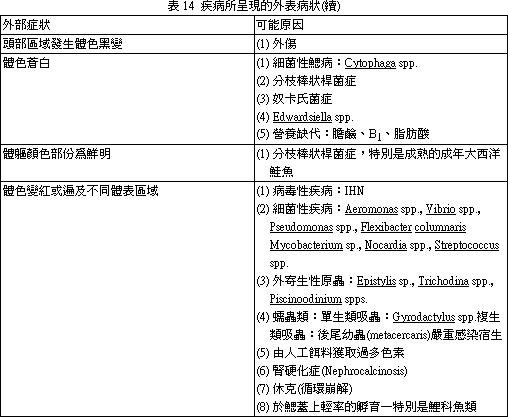






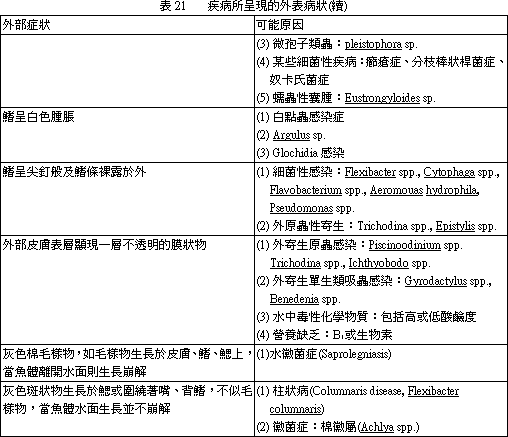




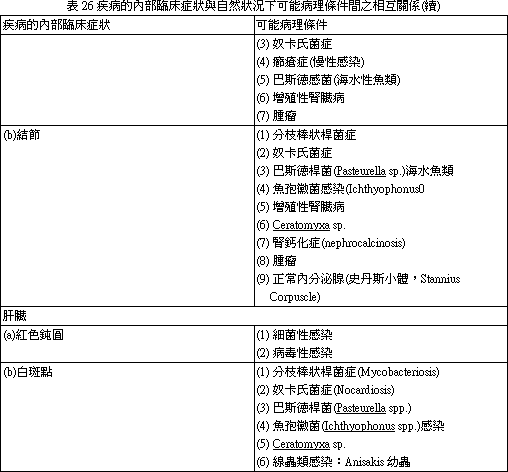

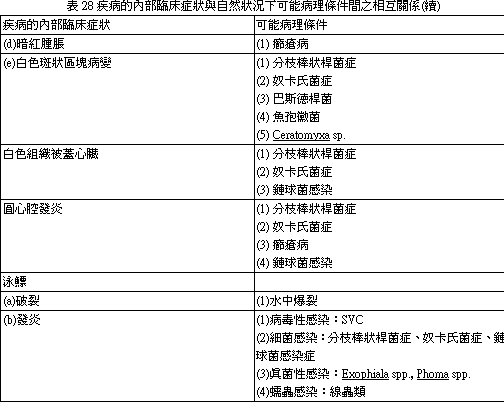
 表30 分離魚類病原細菌之培養基
表30 分離魚類病原細菌之培養基1. Bile Esculin Agar:分離 Streptococcus Group D。 *2. Blood Agar:一般性培養基。 *3. Brain Heart Infusion Broth/Agar:一般性培養基。 4. Briliant Green Agar:分離 Salmonella。 5. Cetrimide Agar:分離 Pseudomomas。 *6. Cooked Meat Medium:分離厭氣菌及保存細菌用。 *7. Cytophaga Agar:分離 Cytophaga (Flexibacter)。 8. Dorset-Egg Medium:分離 Microbacterium。 9. E. ictaluri Isolation Agar:分離 E. ictaluri。 10. Hsu-Shotts Medium:分離 Cytophaga。 11. Kidney Disease Medium-2(KDM2):分離 Renibacterium salmoninarum。 12. Lowenstein-Jensen Medium:分離 Mycobacterium。 *13. MacConkey Agar:分離 Gram(-) 腸內細菌, Aeromonas, Pseudomonas, Edwarsdiella。 *14. Marine Agar:海水細菌一般性培養基。 15. Middlebrook 7H10 Agar:分離 Mycobacterium。 *16. Nutrient Broth/Agar:一般性培養基。 *17. Ogawa's Egg Medium:分離 Mycobacterium。 18. Pseudosel Agar:分離 Pseudomonas。 *19. Rimler-Shotts Medium:分離 Aeromonas hydrophila 及 Edwardsiella tarda。 20. Salmonella-Shigella Agar (SS):分離 Salmonella, Edwardsiella。 21. Selective Kidney Disease Medium (SKDM):分離 Renibacterium salmoninarum。 22. Shotts-Waltman Medium:分離 Yersinia ruckeri。 23. Sodium Azide Blood Agar:分離 Streptococcus。 *24. Thioglycollate Medium:一般性及厭氣菌。 *25. Thiosulfate Citrate Bile-salt Sucrose Agar (TCBS):分離 Vibrio。 *26. Trypticase Soy Broth/Agar:一般性培養基。 [註] *常用培養基 1. 除 No.14 及 25 培養基為分離海水細菌專用者外,其他許多培養基添加 1.5% NaCl 後即可用於海水細菌之培養。 2. 除 No.7、9、10、11、17、19、21、22 培養需自行調配外,其餘均可購市售品應用,上述 8 種自行調配培養基配方如下表: 表31:自配培養基之配方及方法 1. Cytophaga agar又稱
Ordal's medium:分離 Flexibacter sp.
0.05% (w/v) tryptone
0.05% (w/v) yeast extract
0.02% (w/v) sodium acetate
0.02% (w/v) beef extract
1.0% (w/v) agar
PH : 7.2
121℃、15分溼熱滅菌2. Edwardsiella ictaluri isolation medium (Shotts and Waltaman 1989)
tryptone 10 g
yeast extract 10 g
phenylalanine 1.25 g
ferric ammonium citrate 1.2 g
bromothymol blue 0.003 g
bile salts 1 g
agar 15 g
distilled water 980 ml
煮準溶解,冷卻至 50℃,調整 pH:7,溼熱滅菌 121℃、15 分,再冷卻至 50℃ 加入經過濾膜之 mannitol (0.35% v/v) 及 Colistin sulphate (10μ g/ml)3. Hsu-Shotts medium又稱
Selective flexibacter medium (Bullock et al. 1986):分離Flexibacter spp.
0.2% (w/v) tryptone
0.05% (w/v) yeast extract
0.3% (w/v) gelatin
1.5% (w/v) agar
121℃、15 溼熱滅菌,冷卻至 45℃,加入經過濾膜無菌之 neomycin sulphate (0.0004% w/v)4. Kidney disease medium-2 (KDM2):分離 Renibacterium salmoninarum
1.0% (w/v) peptone
0.05% (w/v) yeast extract
0.1% (w/v) L-cysteine hydrochloride
1.5% (w/v) agar
PH:6.5
121℃、15 分溼熱滅菌,冷卻至 45℃,並加入 20% (v/v) 無菌的牛胎兒血清5. Ogawa's egg medium (Tsukamura 1967)
培養 Mycobacterium spp. 及 Nocardia spp.monosodium glutamate 1.0 g KH2PO4 1.0 g Dist. Water 100 ml Glyceral 6 ml Whole eggs 200 ml Malachite green solution (2%) 6 ml 溶解味精及 KH2PO4 於 DW 後,與其他成份混合。 調整 pH6.8,做成斜面,90℃,1 小時滅菌或間歇三次煮沸消毒。 6. Rimler-Shotts medium (Shotts and Rimler 1973):
分離 Aeromonas hydrophila 與 Edwardsiella tarda
0.05% (w/v) L-lysine hydrochloride
0.65% (w/v) L-ornithine hydrochloride
0.35% (w/v) maltose
0.68% (w/v) sodium thiosulphate
0.03% (w/v) L-cysteine hydrochlocride
0.003% (w/v) bromothymol blue
0.08% (w/v) ferric ammonium citrate
0.1% (w/v) sodium deoxycholate
0.0005% (w/v) novobiocin
0.3% (w/v) yeast extract
0.5% (w/v) sodium cholride
1.35% (w/v) agar
PH:7.0
煮沸溶解上述各種成份,此培養基不用溼熱滅菌7. Selective Kidney disease medium (SKDM):分離 Renibacterium salmoninarum
1.0% (w/v) tryptone
0.05% (w/v) yeast extract
0.005% (w/v) cycloheximide
1.0% (w/v) agar
PH:6.8
121℃、15 分溼熱滅菌,冷卻至 50℃,加入牛胎兒血清 (10v/v),及經過濾膜之 L-cysteine hydrochloride (0.1% w/v)、D-cycloserine (0.00125% w/v)、Polymyxin B sulphate (0.0025% w/v)、Oxolinic acid (0.00025% w/v)22. Shotts-Waltman medium (Waltman and Shotts 1984): 分離Yersinia ruckew
0.2% (w/v) tryptone
0.2% (w/v) yeast extract
1.0% (w/v) Tween 80
0.5% (w/v) sodium chloride
0.01% (w/v) calcium chloride hydrated
0.003% (w/v) bromothymol blue
1.5% (w/v) agar
PH:7.4
溼熱滅菌121℃、15分,冷卻至 50℃,加入經過濾膜之蔗糖 (0.5% w/v)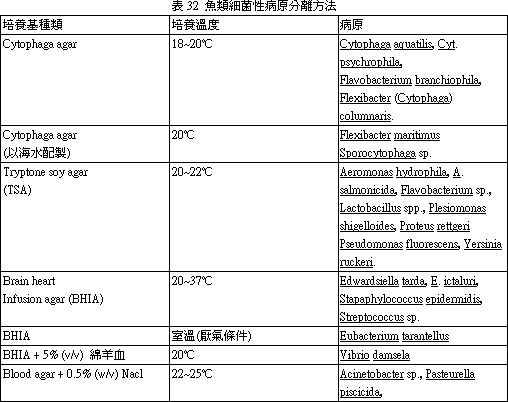
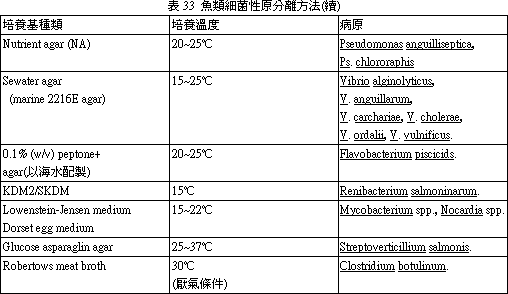 表34 魚病原細菌診斷流程圖
表34 魚病原細菌診斷流程圖
由革蘭氏陰性細菌所引起的魚類病原菌表35魚病原細菌診斷流程圖(續)
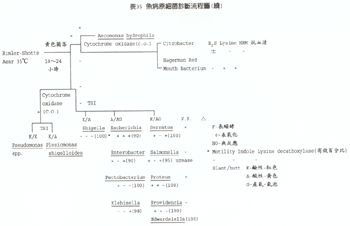 表36 魚病原細菌診斷流程圖(續)
表36 魚病原細菌診斷流程圖(續)
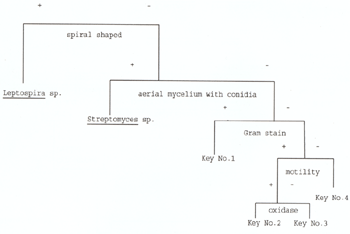
資料來源: Glorioso, J.C. et. al. Laboratory identification of bacterial Pathogens of aguatic animals. Am. J. Vet. Res., Vol. 35。No. 3. 1974 資料來源: 1. 許天來等編譯,魚類死因現場調查手冊,(1993) 魚病專輯 13,P1~3。 2. 黃旭田、涂堅編譯,魚類細菌性疾病之分離與診斷,(1992) 魚病專輯 11,P1~44。 3. 陳清、張湧泉 (1991),赴日研習貝類生理及疾病報告書,台灣省家畜衛生試驗所,水試所鹿港分所P24。 4. 陳清 (1994):病原性細菌鑑定技術,台灣區動物藥品工業同業公會,動物用生物藥品研習會講議。P.9-10。 5. 張文發譯,質量確定及證據之規則 (1993),魚病專輯 13,P70~73。 6. 董明澄,八十三年度水產動物疾病防治人員培育訓練班(初級班)魚類細菌學講義。 7. 龐飛譯,有毒物質 (1993) 魚病專輯 13,P30~41。 17.3 魚類病毒性疾病之診斷 (林德田、林文華) 魚類病毒性疾病之診斷雖然可以利用電子顯微鏡技術進行快速診斷,但是此技術無法更深一層研究病毒之生物學特性,因此,必需依賴組織培養或動物接種方能奏效,其中依動物接種技術分離或分析病毒則費時又費力,所以目前病毒學家均以組織培養系統為分離病毒與診斷魚類病毒性疾病之依據。 17.3. 1 魚類初代細胞之製備 17.3. 1.1 供試材料 活魚
0.25% 胰蛋白脢消化液 (溫水魚-室溫;冷水魚 -10℃)
抗生素 (Streptomycin 100 μg/ml & Penicillin 100 IU/ml)初代細胞培養液: Eagles Minimum Essential Media (EMEM) Leibovitz L15 Medium,pH7.2-7.4 20% 胎牛血清
HBSS 溶液 (Hank's Balanced Salt Solution,HBSS) (冰溶)
消化瓶與外科器具
塑膠製細胞培養瓶
PBS 溶液 (Phosphate Buffer Saline,PBS) (冰浴)
70% 酒精溶液
5% CO2 細胞培養恆溫箱17.3. 1.2 步驟 (1) 還用健康魚經重擊頭部或麻醉魚體,沿鰓與喉頭連接處切開放血。 (2) 將已放血魚體浸泡於 1% Chlorox 溶液中 10 分鐘,再經無菌水浸漬洗滌 3-4 次 (若有鱗魚類者則先去除體側魚鱗再進行此項步驟)。 (3) 利用酒精棉棒擦拭欲切開之魚體側,再切開體腔以露出臟器,並取出內臟如:精巢、卵巢、腎藏與魚鰾。 (4) 將取出之臟器置入冰浴無菌培養皿中,剪除臟器周圍結締組織,並將臟器剪切成細組織碎片。 (5) 細組織碎片置入無菌 50 毫升離心管中,加入 HBSS 溶液中懸浮組織碎片,再經 700-800xg 離心 5 分鐘。 (6) 丟棄 HBSS 上清液加入 5 毫升 0.25% 胰蛋白脢消化液懸浮組織碎片,再將組織碎片懸浮液倒入無菌消化瓶中,並加入 15 毫升胰蛋白脢消化液。 (7) 將消化瓶置於室溫 (冷水魚-10℃) 攪拌消化,每隔 30 分鐘收取細胞懸浮液,大約 3-8 小時組織碎片可完全消化成細胞懸浮液。 (8) 細胞懸浮液經離心與 PBS 溶液洗滌 3-4 次後取其細胞,再加入初代細胞培養液懸浮細胞。 (9) 將製備成之細胞懸浮液培於細胞培養瓶中,再移至適宜溫度之恆溫箱中 (溫水魚:25-30℃,冷水魚:15-20℃)。 (10) 培養 48 小時後觀察細胞生長的情形,此種初代細胞很適合病毒階分析與研究。 17.3. 2 魚類細胞株 (Cell Line) 與初代細胞 (Cell Strain) 之繼代培養 17.3. 2.1 供試材料 培養於培養對中的之細胞:諸如 CHSE-214、RTG-2、FHM、EPC… 等細胞株或初代細胞 (Primary Cell,Cell Strain)
TV消化液 (trypsin-versene digest : 0.25% trypsin,1 : 5,000 EDTA)
抗生素 (Streptomycin 100 μg/ml & Penicillin 100 IU/ml)組織細胞培養液: EMEM 或 L15 培養液
10% 胎牛血清
塑膠製細胞培養瓶
HBSS 溶液
5% CO2 細胞培養恆溫箱17.3. 2.2 步驟 (1) 觀察培養瓶中單層細胞之生長情形及丟棄舊有培養液,以 HBSS 溶液洗滌細胞二次。 (2) 加入適量的 TV 消化液適溫靜置 1 分鐘後,去除消化液再靜置 2 分鐘,在低倍顯微鏡下觀察單層細胞脫落變化。TV 消化液添加量如下: 培養對大小 (平方公分) TV消化液量 (毫升) (Flask) 250.5801.01752.5(3) 震盪輕拍培養瓶使消化細胞脫落,加入 10 毫升 KMEM 培養液懸浮細胞,避免沖散細胞時產生氣泡。以 1:3 的比例分裝到新的培養瓶中,每瓶加入適量胞懸浮液,其每瓶添加量如下: 培養對大小 (平方公分) 細胞懸浮液 (毫升) (Flask) 255-78015-2517550-75(4) 將細胞培養瓶靜置在適溫恆溫箱中 (溫水魚:25-30℃,冷水魚:15-20℃) 每日觀察
細胞生長過程
17.3. 2.3 細胞株的種類 17.3. 2.3.1 目前世界上所確立之細胞株列舉如下: 細胞株 魚種 組織 繼代數目 鮭魚類細胞 ASE Atlantic salmon embryo/epitheloid 83 CHH-1 chum salmon heart/epitheloid 100 CHSE-214 chinook salmon embryo/epitheloid 255 KO-6 kokanee salmon ovary/epitheloid 145 SE chum salmon embryo/epitheloid 201 SHE chum salmon embryo/epitheloid 58 YNK yamame kidney/fibroblast 233 RTE rainbow trout embryo/epitheloid 98 RTE-2 rainbow trout embryo/epitheloid 67 RTG-2 rainbow trout gonads/epitheloid 304 RTH-149 rainbow trout hepatoma/epitheloid 216 RTT rainbow trout tail/fibroblast 83 STE-137 rainbow trout embryo/epitheloid 206 非鮭魚類細胞 BF-2 bluegill caudal trunk/fibroblast 114 BB brown bullhead caudal trunk/fibroblast 100 CAR goldfish fin/fibroblast 72 CCO channel catfish ovary/epitheloid 275 EO-2 Japanese eel ovary/fibroblast 99 EK-1 Japanese eel kidney/fibroblast 88 EPC carp epithelioma/epitheloid 156 EPG goldfish epithelioma/epitheloid 57 FHM fathead minnow caudal trunk/epitheloid 237 SHH snakehead heart/epitheloid 77 WF-1 pond smelt fin/epitheloid 52 TO-2 Tilapia hybrid ovary/epitheloid 365 TK-1 Tilapia hybrid kidney/epitheloid 225 GSE gizzardshad embryo/epitheloid 78 JSKG Japanese stripeknifejaw gonad/epitheloid 64 KRE hybrid of kelp and red spotted grouper embryo/epitheloid 92 KRE-2 hybrid of kelp and red spotted grouper embryo/epitheloid 93 PAS purplish amberjack skin/epitheloid 124 17.3. 3 病毒分離 17.3. 3.1 供試材料 疑似發病魚體
HBSS 溶液
抗生素 (Streptomycin 100 μg/ml & Penicillin 100 IU/ml)細胞培養維持液: EMEM 或 L15 培養液
2% 胎牛血清
24 孔單層細胞培養皿
5% CO2 細胞培養恆溫箱17.3. 3.2 步驟 (1) 取其魚體之內臟如:腎臟、脾臟、肝臟、腸及腦,若是仔魚者則切除頭部、尾部及鰭,只取腹部。 (2) 將取之內臟放入研缽中或無菌袋中磨碎組織臟器,配成 10 倍稀釋組織懸浮液 ( 1 公克組織臟器加 9 毫升 HBSS)。 (3) 繼之將組織懸浮液轉置無菌離心管中,經 1,500rpm 離心 10 分鐘,取其上清液。 (4) 上清液經 10 倍稀釋 ( 0.2 毫升上清液加 1.8 毫升),再經 0.45um 孔徑之過濾膜過濾。亦可每毫升上清液加入 500IU Penicillin、500mcg Steptomycic 及 100IU Gentamycin,混合後靜置適溫 2-4 小時,再經前述離心取其上清液。 (5) 每孔單層細胞加入 0.1 毫升的上清液,接種 1 小時再加入 0.9 毫升細胞培養維持液。另外亦可將 0.1 毫升上清液先置入 24 孔培養皿中,再加入 0.5 毫升細胞懸浮液,接種 1 小時後再加入 0.4 毫升細胞培養維持液。 (6) 最後將感染完成之 24 孔細胞培養皿靜置在適溫恆溫箱中 (溫水魚:25-30℃,冷水魚 15-20℃),每日觀察細胞病變變化如:細胞融合、圓形化、多核細胞或細胞變性……等變化。若有細胞病變出現時可由電子顯微鏡加速確診。 17.3. 4 細胞株在魚病毒性疾病上的應用 細胞株在魚病毒性疾病上的應用列表說明之: 參考文獻 1. Ken Wolf. 1988. Fish Viruses and Fish Viral Diseases. First published 1988 by Cornell University Press. 2. Plumb, J. A. and P. R. Bowser. 1983. Microbial Fish Disease Laboratory Manual. Copyright by Alabama agricultural Experimental Station Auburn University. Printed by Brown Printing Company Montgomery, Alabama First printing. 3. Roselyn, D. F., M. Yoshimizo, Y. Ezura and T. Kimura. 1993. Comparative growth response of fish cell lines in different media, temperature, and sodium chloride concentrations. Gyobyo Kenkyu, 28(1), 27-34.