豬赤痢
- 內容
一、 病歷: 91年7月底本縣一飼養規模約1,000頭之一貫式養豬場送檢一頭5月齡的病死豬,
該病死豬隻外觀呈消瘦、被毛粗剛、尾部可見暗黑色糞污粘著,而且自今年6月以來
該場肥育舍即陸續出現肥育豬隻下血痢的情形,發病率約為80/400,累積已有17頭3
.5月齡豬隻死亡。根據畜主表示已經投予Amoxicillin、Chloramphenicol、OTC等抗
生素均未見改善。二、 肉眼病變:
1.
腹腔:剖檢時可見腹腔有少量的暗紅色腹水蓄積。 2.
心臟:左心室心內膜處可見輕微之刷狀出血。 3.
肝臟:輕微腫脹,表面可見數個直徑1.2公分的白色斑點。 4.
肺臟:左側肺臟呈濕重潮紅,右側肺臟局部區域可見氣腫。 5.
腎臟:於右側腎臟可見1公分直徑之水樣囊腫。 6.
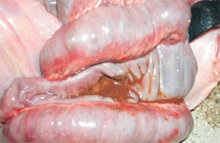
大腸:大腸內容物呈暗紅色液體,大腸(盲腸、結腸)黏膜面可見瀰漫性灰白色偽
膜覆蓋。(圖1, 2)三、 組織病變: 1.
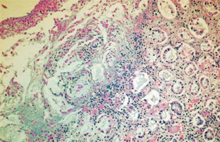
大腸:黏膜面呈嚴重且瀰漫性表淺層壞死,黏膜固有層可見嗜中性球及細胞碎片聚
集,於腺窩腔可見多量菌體。(圖3)2.
肺臟:鬱血,局部細支氣管旁可見淋巴結節浸潤。 3.
心肌:局部心肌鬱血。 4.
肝臟:門脈三角區之結締組織可見少量淋巴細胞浸潤。 5.
腦:正常。 四、 實驗室檢驗: (一)細菌分離
(二)腸黏膜糞便塗抹片檢查1. 膽囊:陰性。 2.大腸內容:經API 20E生化鑑定系統鑑定結果為Proteus vulgaris 、Citrobacter
diversus及Serratia marcescens。
(三)豬瘟螢光標示抗體檢測大腸黏膜塗抹片以Diff-Quick染色劑染色,結果可見到螺旋狀菌體。
(四)特殊染色取扁桃腺、淋巴結、脾臟、空腸等組織,以冷凍切片進行豬瘟螢光標示抗體染
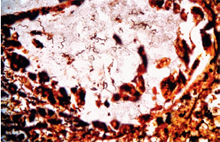
色,各臟器結果均為陰性。取大腸之石蠟切片,以Warthin-Starry法染色,結果於黏膜固有層及腺窩腔中可
見螺旋狀菌體。(圖4)五、 診斷: 豬赤痢(Swine Dysentery) 六、 討論:
編者意見:1.
本病於1921年即由Whiting等人首次發表。然而本病卻一直存在於豬場中無法徹底
清除,尤其是肥育豬舍,Pearce於1999年發表英國在3年中肥育豬腸道疾病的統計
中提到,腸道疾病在肥育豬為最主要的問題,美國13.6%的肥育豬死於腸道性疾
病,報告中指出豬赤痢的發生比例為10.5%;而豬群間的糞便污染為此類疾病蔓延
的最重要因素,其次為小豬剪尾及使用濕料餵飼;確實的消毒為控制腸道疾病發生
的最佳方法。2.
本病例由大腸內容物分離豬赤痢病原時,雖採厭氣培養但並未使用選擇性培養基,
以致分離的結果受到其他細菌的污染,此次所分離到的Proteus vulgaris 、
Citrobacter diversus 、Serratia marcescens皆是存在於糞便中的機會性病原菌
(Opportunistic pathogens)。臨床上,要從大腸內容或肛門拭子分離豬赤痢菌
(Brachyspira hyodysenteriae),常受到其他腸內菌的污染而導致分離失敗。為了抑
制這些雜菌,可於Blood agar(5% sheep blood)加入Spectinomycin(400μg /ml),
培養過程中使用厭氧包提供適量的H2與CO2則有助B. hyodysenteriae生長,在血液培
養基上形成β溶血的菌落;另一培養基配方,則可增加本菌的生長量,使用
Fastidious Anaerobic agar加5% sheep blood及1% sodium RNA,此外對於B.
hyodysenteriae與B. innocens的溶血現象有較佳的區別效果3.
豬赤痢需與豬沙門氏菌、增生性腸炎、鞭蟲症、胃潰瘍、梭菌性腸炎做類症鑑別。 4. 有報告指出飼料中的可溶性非澱粉多醣類(soluble non-starch polysaccharides)如大
麥與小麥,與抗性澱粉(resistant starch)如玉米澱粉或豆類,在豬隻腸道不易被吸
收,主要因為小腸中的消化酵素所分解,如果飼料中這些成分較多的話,將會導致
大腸異常醱酵,進一步促成腸道環境有利豬赤痢螺旋菌等厭氣性腸道病原菌發展,
將造成豬赤痢的疫情更嚴重。5. 本次發生豬赤痢的豬場四周都是水稻田,而本病例發生的時間恰逢水稻收割季節,
稻米收割後躲在田間的老鼠,因為找不到食物而四處亂竄,常可見到老鼠進入豬舍
內偷吃飼料,於是造成本病水平傳染的媒介,所以減少豬舍內老鼠的數量,亦可降
低本病的發生機率。1. 建議再至該場採樣以選擇性培養基分離細菌。
2. 一般豬病病原主要存在豬群中,故為疾病的傳染散播來源,本病之病原
是否會感染老鼠並造成豬群中散播,宜進一步查明。七、 參考文獻: 1.
臨床豬病學。中華民國獸醫學會。1984。華香園。 2.
Durmic Z, Pethick DW, Pluske JR, and Hampson DJ. Changes in bacterial populations in
the colon of pigs fed different sources of dietary fibre, and the development of swine
dysentery after experimental infection. Journal of Applied Microbiology 85: 574-582,
1998.3.
Pearce GP. Epidemiology of enteric disease in grower-finisher pigs: a postal survey of pig
producers in England. Veterinary Record 144: 338-342, 1999.4.
Pluske JR, Zorica Durmic, Pethick DW, Mullan BP, and Hampson DJ. 1998.
Confirmationation the role of the rapidly fermentable carbonhydrates in the expression of
swine dysentery in pigs after experimental infection. Journal of Nutrition 128(10): 1737-
1744, 1998.5.
Quinn PJ, Carter ME, Markey B, and Carter GR. Clinical veterinary microbiology.
Mosby-Year book, Inc., London England, 1994.6.
Straw B, Allaire SD, Mengeling WL, and Taylor DJ. Disease of swine 8th edtion. Iowa
State University Press, Ames, Iowa U.S.A, 1999.7.
Taylor DJ. Pig disease 7th edtion. St Edmundsbury Press Ltd, Bury St Edmunds, Suffolk,
Great Britain, 1999.